Переломы при ревматоидном артрите

Переломы костей скелета у больных ревматоидным артритом возникают в 1,5-2 раза чаще, чем в популяции, являются одной из причин снижения качества жизни, инвалидизации и смерти больных. В настоящем исследовании, включавшем 254 женщины с ревматоидным артритом (диагноз был установлен по критериям Американской коллегии ревматологов) в возрасте от 18 до 85 лет, с давностью заболевания от полугода до 42 лет, сравнивали группу пациенток с переломами и без переломов в анамнезе с целью идентификации факторов рисков переломов при РА. Переломы в анамнезе ассоциировались с приемом глюкокортикостероидов (ГКС), более высокой кумулятивной дозой и более длительным приемом ГКС. Также отмечено, что в группе пациенток с переломами показатели минеральной плотности кости (МПК) были ниже во всех исследуемых участках скелета. На основании проведенного сравнения наиболее вероятными факторами риска переломов у больных ревматоидным артритом являются возраст, длительный прием ГКС в высоких дозах, низкие значения МПК, тяжелое течение ревматоидного артрита и его осложнения.

Таблица 1. Антропометрическая и клинико-рентгенологическая характеристика включенных в исследование пациенток с ревматоидным артритом: группы с переломами и без переломов в анамнезе
Таблица 2. Сравнительная частота выявления остеопороза по показателю МПК в различных отделах скелета в группах больных ревматоидным артритом с переломами и без переломов в анамнезе*
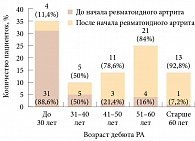
Рисунок. Возникновение первого перелома у больных ревматоидным артритом в зависимости от возраста возникновения перелома и наступления заболевания
Таблица 3. Характеристика больных с переломом шейки бедренной кости
Ревматоидный артрит (РА) – наиболее распространенное аутоиммунное воспалительное заболевание неизвестной этиологии, характеризующееся хроническим эрозивным артритом (синовитом) и системным поражением внутренних органов. В мире этим заболеванием страдают от 0,5 до 1% людей [1]. Среди наиболее частых социально значимых, жизнеугрожающих осложнений течения и терапии РА рассматриваются сердечно-сосудистые катастрофы, тяжелые инфекции, амилоидоз и переломы различных локализаций, которые, по данным зарубежных авторов, у больных РА возникают в 1,5-2 раза чаще, чем в популяции. Что касается перелома шейки бедра (ШБ), наиболее опасного перелома в отношении дальнейшего прогноза для жизни и трудоспособности, его относительный риск (ОР) достигает 2,1 [2]. По данным финских авторов, этот показатель еще выше – 3,26 [3]. Не менее значимыми причинами снижения качества жизни и инвалидизации являются деформации и переломы позвонков. У больных РА они случаются в 2-4 раза чаще, чем в популяции [4-6].
К наиболее значимым факторам риска переломов у больных РА относятся: снижение минеральной плотности кости (МПК), прием и кумулятивная доза глюкокортикостероидов (ГКС), менопауза, низкий индекс массы тела (ИМТ), склонность к падениям. Однако наибольший интерес представляет вклад самого заболевания и его течения, хронического воспаления и концентрации провоспалительных цитокинов в моделирование и ремоделирование костной ткани, в увеличение риска переломов у больных РА.
Как известно, периартикулярный остеопороз – наиболее ранний признак изменений в костной ткани при РА. Генерализованный остеопороз присоединяется позже. Установлено, что в патогенезе вторичного остеопороза и эрозивно-деструктивных изменений в суставах при РА ключевую роль играют провоспалительные цитокины (фактор некроза опухоли альфа, интерлейкины 6, 1 и др.). Провоспалительные цитокины способны связываться с рецепторами на поверхности остеокластов и запускать процессы костной резорбции. Из-за дисбаланса между костеобразованием и костной резорбцией нарушается минерализация, изменяется структура и микроархитектоника костной ткани, уменьшается плотность кости. Это приводит к возникновению остеопороза, снижению прочности кости, а в конечном итоге – к переломам.
В ряде зарубежных исследований были проанализированы возможные факторы риска (ФР) переломов у больных РА. В некоторых работах использовали небольшие выборки, что повлияло на репрезентативность полученных результатов [7, 8]. В одних исследованиях изучались конкретные локализации переломов (только вертебральные [1, 4, 7, 9] или, напротив, вневертебральные [3, 10]), в других – круг анализируемых потенциальных факторов риска был слишком мал и многие важные характеристики РА или терапии ГКС не рассматривались [11]. Таким образом, вопросы, у каких больных РА имеется максимальный риск переломов, кому из них в первую очередь назначать профилактические или лечебные мероприятия и на каком этапе, остаются нерешенными.
Цель исследования – охарактеризовать группы больных РА с переломами и без переломов в анамнезе для дальнейшего выделения возможных факторов риска переломов.
Материалы и методы исследования
Данная работа представляет собой фрагмент многоцентровой программы «Остеопороз при ревматоидном артрите: диагностика, факторы риска, переломы, лечение», проведенной в 2010-2011 г. и включавшей мужчин и женщин в возрасте 18 лет и старше с достоверным диагнозом «ревматоидный артрит» в соответствии с критериями Американской коллегии ревматологии (American College of Rheumatology, ACR) 1987 г., с исходной денситометрической оценкой МПК и возможностью динамического наблюдения на протяжении не менее 3 лет. Для настоящего исследования были отобраны 254 женщины в возрасте от 18 до 85 лет с давностью заболевания от полугода до 42 лет. На всех больных были заполнены специально разработанные тематические карты, данные внесены в таблицу Exсel для дальнейшей статистической обработки. Сведения о больных включали результаты опроса, оценку коморбидных состояний, осмотр, анализы крови (скорость оседания эритроцитов (СОЭ), тест на C-реактивный белок (СРБ), гемоглобин, общепринятые биохимические показатели), оценку активности заболевания (DAS28 – disease activity score) и опросник для оценки состояния здоровья (HAQ – Health Assessment Questionnaire). Пациенткам была выполнена рентгенография кистей и стоп, грудного и поясничного отделов позвоночника в боковой проекции. Подсчет общего числа эрозий и сужений суставных щелей по методу Sharp проведен у 108 больных, оценка индекса деформаций по методу Genant – у 173 больных в возрасте от 18 до 65 лет. МПК в поясничном отделе позвоночника (L1-L4) определена у 198 больных, в проксимальном отделе бедренной кости – у 184, в костях предплечья (средняя треть лучевой кости) – у 134 с использованием двухэнергетической рентгеновской абсорбциометрии (dual-energy X-ray absorbtiometry – DXA) на аппарате Hologic QDR1000. У женщин в постменопаузальном периоде диагноз остеопороза был установлен по T-критерию ≤ -2,5 стандартных отклонения (СО) от пика костной массы, у женщин с сохраненным менструальным циклом – по Z-критерию ≤ -2,5 СО в соответствии с рекомендациями Международного общества по клинической денситометрии 2007 г. [12]. Значения МПК от -1 до -2,5 СО по T- или Z-критерию у женщин после/до менопаузы соответственно свидетельствовали об остеопении.
Были проанализированы данные анамнеза: характер перелома (низкоэнергетический или полученный в результате травмы при падении с высоты собственного роста), возраст больных на момент возникновения перелома, возникновение перелома до/после наступления РА, менопаузы, количество и локализация переломов. Сведения о переломах подтверждены медицинской документацией или рентгенограммами.
Статистическая обработка материала выполнена с использованием программ Microsoft Excel, Bioistics Version 4.03, istic 6.
Результаты
254 больных РА были разделены на две группы. В 1-ю группу вошла 101 (39,8%) пациентка с низкоэнергетическими переломами в анамнезе, во 2-ю группу – 153 (60,2%) пациентки без переломов. Основные характеристики больных каждой группы представлены в табл. 1.
Средний возраст пациенток 1-й группы составил 59,8 ± 11,8 года, 2-й группы – 56,1 ± 11,4 года (р
Больше половины больных обеих групп имели III или IV рентгенологическую стадию РА по Штейнброкеру. При этом IV стадия РА встречалась достоверно чаще в группе больных с переломами (р 0,05).
Различий в оценке степени активности заболевания по показателю DAS28 между группами не выявлено. В обеих группах на момент исследования преобладали больные с умеренной степенью активности. Среднее значение показателя HAQ оказалось выше в группе больных с переломами – 1,720 ± 0,755 vs 1,431 ± 0,806 (р 2 баллов имели 39,5 и 24,8% женщин 1-й и 2-й группы соответственно (р
Внесуставные проявления РА отмечались у 58 (59,8%) пациенток с переломами и у 58 (39,5%) пациенток без переломов (р
Больных, получавших терапию ГКС свыше 3 месяцев, было достоверно больше в 1-й группе (78,2 vs 66,7%, р
Что касается терапии базисными противовоспалительными препаратами (БПВП), на момент обследования в 1-й группе меньшее количество больных получали БПВП (80,2 vs 89,5%, р
Особое внимание уделялось анализу показателей МПК (табл. 2). Так, остеопороз в поясничном отделе позвоночника (L1-L4), по данным рентгеновской денситометрии, был установлен у 42,7% больных 1-й группы и у 26,5% больных 2-й группы (р 0,05) соответственно. Остеопороз в ШБ также достоверно чаще наблюдали у больных с переломами в анамнезе по сравнению с пациентами без переломов (39,4 vs 24,1%, р 0,05) соответственно. В костях предплечья остеопороз диагностирован у 67,3% женщин в группе с переломами и у 41% – в группе без переломов (р
Мы сопоставили в группах частоту осложнений РА (амилоидоз и остеонекроз) и сопутствующих заболеваний (гипотиреоз, артериальная гипертония, сахарный диабет, эрозивно-язвенные поражения желудочно-кишечного тракта, хронические обструктивные заболевания легких), негативное влияние которых на состояние костной ткани подтверждено данными литературы. Сопутствующие заболевания были выявлены у 85 (84,2%) больных 1-й группы и у 108 (70,6%) пациенток 2-й группы (р
При анализе возраста больных на момент возникновения первого низкоэнергетического перелома, его характера и локализации, связи с РА, приемом ГКС и менопаузой выяснилось, что у 45 (44,5%) женщин перелом возник до начала РА в возрасте 26,5 ± 16 лет, у 56 (55,5%) – после начала заболевания. Средний возраст на момент перелома составлял 51,6 ± 13,7 года (рисунок). У 46 (46,5%) больных переломы возникли после наступления менопаузы, у 53 (53,5%) – до наступления. У 50 пациенток из 101 в анамнезе было более одного случая низкоэнергетического перелома. Всего установлено 178 случаев переломов. Наиболее частыми локализациями переломов оказались кости предплечья – 32 (18%) случая – и кости голени – 24 (13,5%) случая. Переломы позвонков (в том числе деформации с индексом по Genant
Мы выделили подгруппу больных (n = 20) с переломами, дебют заболевания у которых приходился на возраст от 16 до 30 лет (в период моделирования костной ткани и формирования пика костной массы). Средний возраст на момент возникновения первого перелома у этих пациенток составил 32,3 ± 17 лет. У 9 (45%) больных в подгруппе было более одного перелома, всего отмечено 37 случаев переломов, или 20,8% всех проанализированных переломов. На переломы предплечья пришлось 7 (21,9%) случаев в группе с дебютом РА от 16 до 30 лет, переломы голени – 4 (16,7%), переломы позвонков – 5 (26,3%), переломы бедра – 4 (40%) случая.
Обсуждение
Из 254 больных РА, включенных в исследование, более трети (39,8%) имели в анамнезе низкоэнергетические переломы. Согласно результатам анализа, полученным в ходе данного исследования, переломы ассоциировались с возрастом (59,8 ± 11,8 года), наступлением менопаузы, большей длительностью РА, в том числе свыше 10 лет. Также для больных с низкоэнергетическими переломами были характерны более частая терапия ГКС свыше 3 месяцев, длительный прием ГКС (в среднем 84,4 ± 67 месяцев) и кумулятивная доза в среднем 19,037 ± 18,724 г. У таких больных чаще отмечались внесуставные проявления, осложнения РА (амилоидоз и остеонекроз). Не вызвала сомнений связь между возникновением переломов и низкой МПК.
В отличном по дизайну исследовании S.Y. Kim, в котором ФР переломов определялись путем сопоставления больных РА и пациентов без РА, авторы установили, что высокому риску остеопоротических переломов подвержены лица в возрасте 65-74 лет (относительный риск (ОР) 2,18 для больных РА по сравнению с пациентками без РА). Однако наибольшее значение, по результатам данного исследования, имели предшествующие переломы (ОР 5,97, 95% доверительный интервал (ДИ) 5,29-6,75) и женский пол (ОР 1,89, 95% ДИ 1,73-2,07). Прием пероральных ГКС в анамнезе также имел значение (ОР 1,15, 95% ДИ 1,03-1,27). Авторами не отмечено существенного влияния снижения МПК на риск возникновения переломов у больных РА [13].
В самой масштабной по количеству участников работе британских ученых проанализированы наиболее значимые факторы риска переломов у больных РА и пациентов группы контроля. Показано, что больные РА имели повышенный риск переломов, особенно переломов бедра и позвонков. Наибольшее влияние на вероятность возникновения переломов (в частности, переломов бедра) оказали, по мнению авторов, длительность РА свыше 10 лет, низкий ИМТ, а также прием ГКС. Исследователи отметили, что риск переломов у больных РА оставался высоким даже при исключении при расчетах лиц, когда-либо принимавших ГКС: ОР составил 1,3 (95% ДИ 1,2-1,4) для остеопоротических переломов и 1,7 (95% ДИ 1,5-2) для переломов бедра. Как отметили сами авторы, незначительная роль ГКС в возникновении переломов, вероятно, связана с тем, что в данном исследовании лишь четверть больных РА принимали ГКС, что отражает ситуацию в Европе, но не в странах Нового Света (в том числе в США), где терапией ГКС охвачены до 75% больных РА [5].
В проспективном когортном исследовании японских ученых с участием 1733 женщин, больных РА, были определены наиболее значимые ФР переломов, в частности возраст старше 70 лет, высокие значения HAQ, низкий СРБ и переломы в анамнезе. О влиянии ограничения функциональных возможностей и снижения физической активности, которые в значительной мере отражаются при подсчете показателя HAQ, сообщалось неоднократно. В данном исследовании особенно высоко оценено значение данного показателя для риска возникновения переломов костей любой из анализируемых авторами локализаций [11]. В нашем исследовании группе больных РА с переломами в анамнезе также соответствовало высокое среднее значение HAQ.
При анализе показателей мы не получили статистически значимых различий и связи переломов с активностью РА по DAS28 и рентгенологической характеристикой заболевания по индексу Sharp на момент исследования. Субъективные оценки врача степени активности РА и функциональной недостаточности также не различались. В большинстве работ, посвященных изучению ФР переломов у больных РА, в которых выявлена связь между высокой активностью болезни и случаями переломов, помимо клинических параметров активности учитывали лабораторные показатели (СРБ, СОЭ, ревматоидный фактор и др.) [1, 6]. Другой причиной таких результатов может быть особенность выборки больных для исследования (например, только госпитализированные в лечебно-профилактические учреждения больные, текущая активность заболевания большинства из которых была высокой). В нашем исследовании были использованы данные как амбулаторных, так и стационарных больных. Более чем у половины из них активность заболевания была умеренной. Следует отметить, что для оценки вклада воспалительной активности в риск возникновения переломов необходимо наблюдать больных в динамике с анализом эффективности антиревматической терапии и приверженности лечению.
Нельзя не сказать и о связи между низкими показателями МПК во всех анализируемых областях и переломами у наших больных. Как известно, характеристика костной ткани (масса, плотность, архитектоника, степень минерализации и др.) – показатель прочности кости, а остеопороз – чрезвычайно значимый ФР возникновения переломов у больных РА. Негативная роль снижения МПК неоднократно подтверждена в зарубежных исследованиях ФР переломов [1, 10, 14, 15]. Казалось бы, связь между остеопорозом и риском возникновения переломов не должна вызывать сомнений: лица с низкой костной массой подвержены большему риску переломов [16]. Тем не менее, по литературным данным, этот вопрос остается спорным [4, 8, 17] и требует дальнейшего изучения. РА является фактором, способствующим потере МПК, заболеванием, увеличивающим риск развития остеопороза (уровень доказательности А) [18].
Таким образом, нами получены и проанализированы сведения о больных РА с переломами и без таковых в анамнезе, включающие антропометрические, клинико-рентгенологические характеристики и результаты денситометрии. Представлены данные о случаях низкоэнергетических переломов в анамнезе у больных РА и предварительные результаты сравнительного анализа ФР в группах больных с переломами и без таковых. Более детальный (корреляционный и дискриминантный) последующий анализ позволит установить вклад каждого фактора и определить индивидуальный прогноз развития переломов у больных РА, разработать тактику лечебно-профилактических мероприятий.
Источник
Большинство пациентов, которые обращаются к ревматологу с посттравматическим артритом сустава, склонны игнорировать бытовые повреждения. Поскользнувшись на обледенелой дорожке, такие люди отряхиваются и идут дальше, потирая ушибленную спину. Потянув запястье в спортзале, забывают об этом до следующей тренировки. Но даже если боль после травмы сустава стихает сама через несколько дней, возможны отсроченные во времени последствия. Даже незначительная травма может спровоцировать воспаление, которое влечет дегенеративные процессы в хряще. А если незначительные повреждения имеют повторяющийся характер (например, во время работы), ресурс организма исчерпывается еще быстрее.
В зоне риска по посттравматическому артриту находятся мужчины от 20 до 50 лет, а также женщины в возрасте 30-60 лет. Каждый 7-й пациент, страдающий от артрита, жалуется именно на посттравматическую патологию. Иногда заболевание встречается у детей и подростков. Дополнительным фактором риска выступает избыточный вес.
Посттравматический артрит: причины, механизм развития
Причиной посттравматического артрита выступает повреждение сустава, а также околосуставных тканей – мышц, связок, сухожилий, костей, сосудов, нервов. Сам хрящ страдает достаточно редко в силу его глубокого расположения, но расположенные рядом очаги воспаления влияют на плотность и толщину гиалинового хряща, скорость его износа.
Из-за воспаления и отека после травмы сустава проводимость тканей ухудшается, питательные вещества не попадают в сустав, наблюдается иннервация. Как следствие, хрящевая выстилка сустава утрачивает эластичность, появляется износ опорных поверхностей (на первых порах, в виде очагов эрозии). Поскольку хрящ больше не поглощает удары, вибрации и давление, которые наши кости испытывают при ходьбе и других нагрузках, их принимают на себя головки субхондральных костей, не предназначенные для этого.
Попытки организма компенсировать дистрофию хрящевой ткани приводят к субхондральному остеосклерозу (утолщение костной ткани) и ишемии (недостаточному кровоснабжению пораженного участка).
При этом по краям сустава, вокруг его опорных поверхностей, наблюдается разрастание хрящевой и костной ткани, появление выступов – остеофитов. Этот процесс блокирует сустав, ухудшает его подвижность.
Повреждения могут возникнуть вследствие:
- бытовой или производственной травмы;
- спортивной травмы;
- травм, полученных при ДТП, нападении животных и прочем;
- хирургического вмешательства, реанимационных и других медицинских мероприятий
Зачастую посттравматический артрит суставов возникает на фоне ушибов, вывихов и подвывихов, растяжения или разрыва связок, сухожилий, разрывов или повреждений менисков. Патологический процесс не всегда запускает серьезная травма – иногда это может быть череда мелких повреждений (ударили молотком, прищемили пальцы, постоянно ушибаетесь об угол мебели) или единичная повторная травматизация уже поврежденного участка (например, поврежденное в спорте запястье получило дополнительную нагрузку во время бытовых дел).
Симптомы посттравматического артрита
Болезнь может протекать в острой и хронической формах, при этом интенсивность проявления симптомов будет отличаться. ПА может развиться стремительно, в течение пары недель после травмы, а может годами и десятилетиями тянуться до первого обострения.
Пациенты наблюдают признаки, характерные для всех типов артрита:
- боль и ломота в пораженном суставе;
- локальное повышение температуры;
- тугоподвижность и сокращение объема произвольных движений;
- неприятный хруст при сгибании.
Боль после травмы сустава может не проходить в течение длительно времени. Часто болезнь сопровождается припухлостью, образованием отеков. При наличии сильного воспаления наблюдается повышение общей температуры тела, лихорадка, озноб, лейкоцитоз (определяется лабораторно).
Чаще всего симптоматика посттравматического артрита наблюдается в коленных и тазобедренных суставах, но болезнь может начаться в локтевых, голеностопных и даже плечевых суставах. Реже наблюдается посттравматический артрит других суставов – межфаланговых сочленений пальцев рук, плюснефалангового сустава больших пальцев ног, межпозвоночных суставов.
Диагностика посттравматического артрита сустава
Для уточнения диагноза врач-травматолог или ревматолог может назначить:
- общий и биохимический анализ крови/мочи (как правильно, достаточно для исключения схожих заболеваний);
- иммунологический анализ крови/синовиальной жидкости.
При диагностике важно установить степень повреждений и наличие патологических процессов в суставе. Для этого используется:
- рентгенография (обнаруживает скопления гноя в суставной сумке, наличие костных обломков, остеосклеротических изменений);
- компьютерная томография (полная оценка пораженного сустава);
- МРТ (указывает на наличие эрозии, дистрофии хряща, костных дефектов);
- артроскопия (для внутреннего осмотра суставов и мелких медицинских манипуляций);
- УЗИ (для оценки состояния околосуставных тканей).
Лечение посттравматического артрита
Лечение болезни предполагает сочетание фармако-, физиотерапии и немедикаментозных методик. Несмотря на хроническое течение ПА, на ранних стадиях заболевание хорошо поддается терапии и может выходить в длительную (до нескольких лет) ремиссию без обострений.
Курс лечения и поддерживающей терапии назначается врачом индивидуально, с учетом стадии дегенеративного процесса, возрастных особенностей, комплекции, образа жизни и других особенностей пациента.
Правильно подобранное лечение посттравматического артрита:
- сдерживает прогрессирование болезни;
- уменьшает боль и воспалительный процесс;
- сохраняет подвижность сустава;
- позволяет пациенту вести полноценную жизнь с минимальными ограничениями.
Курс занимает длительное время. “Недолеченная” острая стадия болезни приводит к быстрому ее прогрессированию.
Медикаментозное лечение посттравматического артрита
Лекарственная терапия ведется постадийно: сначала снимается острое воспаление, потом назначаются поддерживающие средства, которые нацелены, в основном, на регенерацию хряща, нормализацию обменных процессов в тканях.
Еще до постановки диагноза при травме сустава врач, как правило, назначает нестероидные обезболивающие (НПВП), которые помогают снять воспаление. Лишь если они оказываются неэффективны, в терапию включаются стероидные средства (глюкокортикоиды).
В зависимости от характера внутрисуставных повреждений назначаются другие препараты (например, остеогенные, антибактериальные), ангиопротекторы, внутрисуставные инъекции хондропротекторов и НПВП.
Противовоспалительные мази, кремы и гели можно использовать на постоянной основе, в т.ч. для профилактики обострений, снятия болей во время основной терапии суставов после травмы. Рекомендуется втирать их в пораженную область перед физическими нагрузками.
В последние годы все более популярным становится применение биостимуляторов для выработки хондробластов (молодых клеток хряща, способных к делению) – плазмолифтинг. Эти биологические препараты изготавливаются из собственной плазмы крови пациенты и запускают регенеративные процессы не только в хрящевой ткани, но и в костях, связках и мышцах. Эффект достигается за счет воздействия на ткани т.н. факторов роста и цитокинов.
Немедикаментозная терапия
Немедикаментозное лечение посттравматического артрита суставов включает физиотерапию (аппаратную, иглорефлексотерапию, массаж, грязелечение), снижение веса, поддержание рациона и моциона. В состоянии ремиссии рекомендована лечебная гимнастика (ЛФК). Она помогает сохранить двигательную функцию сустава и объем произвольных движений, укрепляет мышцы и улучшает их аэробное состояние. При достаточном развитии т.н. “антигравитационные” мышцы человека помогают правильно распределить и снизить нагрузку на больные сочленения. А значит, боль после травмы сустава уменьшится, обострения будут случаться реже и протекать мягче.
Гимнастические упражнения при ПА необходимо выполнять сидя, лежа или в воде, под присмотром инструктора. Занятия проводятся по индивидуальной программе, в формате коротких разминок в течение дня (2-3 раза по 15 минут).
Также эффективно сочетание эрготерапии (лечебный труд) с ношением ортезов для суставов после травмы. Важно поддерживать щадящий ортопедический режим – носить утепляющие наколенники, налокотники или перчатки в холодную погоду, избегать частых подъемов по лестнице, статических нагрузок.
В тяжелых случаях врач совместно с пациентом принимает решение об эндопротезировании – деформированный или срощенный сустав извлекается, а на его место устанавливают искусственный. В этом случае потребуется месячная реабилитация. Протезирование бывает частичным или полным. Иногда требуется очистка суставной сумки от костных обломков, пересадка хряща, выравнивание коленного сустава или другие операции.
Лечение сустава после травмы
Адекватное лечение травмы – главный способ профилактики ПА. В оставленном без лечения суставе, помимо артрита, возникают и другие патологии – синовит, бурсит, гемартроз. Они могут протекать скрытно, например, при закрытом кровоизлиянии. Внутрисуставной перелом тоже может заявлять о себе только отеком и болью – часто его пытаются лечить мазями в то время, как требуется полное обездвиживание сустава.
Поэтому при травмировании тканей важно как можно скорее обратиться в травмпункт, даже если боль после травмы сустава кажется терпимой. Рентгенологические и лабораторные методы исследования позволяют оценить степень полученных повреждений и предупредить воспалительный процесс, восстановить питание тканей. Высока вероятность, что инцидент обойдется без последствий и посттравматического артрита удастся избежать.
Для лечения травмы суставов и околосуставных тканей преимущественно применяются те же группы препаратов и методики, что и для лечения ПА – противовоспалительные (системного и местного действия), обезболивающие, с трофическим эффектом – но в других дозировках.
При лечении сустава после травмы показана физиотерапия. При необходимости назначаются малоинвазивные вмешательства (например, пункция сустава – удаление скопившейся жидкости) или хирургические операции. Как правило, показана иммобилизация поврежденного сустава при помощи наложения гипсовой повязки, лонгета или другого ортеза. После снятия гипса необходимо посетить врача-реабилитолога и первоначально ограничить нагрузки лечебной гимнастикой. Дело в том, что при обездвиживании выработка синовиальной жидкости (суставной смазки) не происходит, она выделяется под давлением на хрящ. Первая же серьезная нагрузка на “пересохший” сустав может спровоцировать новое воспаление и эрозию.
В пожилом возрасте лечение посттравматических патологий занимает больше времени. Параллельно с лечением собственно травмы специалист может назначить терапию от остеопороза – наиболее распространенной причины переломов у людей в возрасте.
Возможные осложнения посттравматического артрита суставов
При отсутствии своевременного лечения посттравматический артрит имеет тенденцию к переходу во вторичный посттравматический артроз, связанный с сильным разрушение суставных поверхностей. Как следствие, нередко возникает деформация сустава, прогрессирующие боли, стойкая контрактура (ограничение подвижности), которая устраняется только хирургическим путем. Возможно появление ложного сустава, хромота. Наблюдаются нарушения со стороны сосудистой и нервной системы в местах травмы сустава.
Берегите себя и своих близких!
Источник
