Переломы при лучевой болезни
ÐÑобенноÑÑи Ð·Ð°Ð¶Ð¸Ð²Ð»ÐµÐ½Ð¸Ñ Ð¿ÐµÑеломов коÑÑей на Ñоне лÑÑевой болезни.
Â
ÐÑобенноÑÑи Ð·Ð°Ð¶Ð¸Ð²Ð»ÐµÐ½Ð¸Ñ Ð¿ÐµÑеломов коÑÑей на Ñоне лÑÑевой болезни. ÐоÑÑÑ ÑвлÑеÑÑÑ Ð²ÐµÑÑма ÑÑвÑÑвиÑелÑной ÑканÑÑ Ðº ионизиÑÑÑÑей ÑадиаÑии. ÐлиÑние поÑледней на коÑÑнÑÑ ÑÐºÐ°Ð½Ñ Ð·Ð°Ð²Ð¸ÑÐ¸Ñ Ð¾Ñ Ð´Ð¾Ð·Ñ Ð¸ пÑодолжиÑелÑноÑÑи облÑÑениÑ. ÐалÑе Ð´Ð¾Ð·Ñ Ð²Ð½ÐµÑнего или внÑÑÑеннего облÑÑÐµÐ½Ð¸Ñ Ð¾ÐºÐ°Ð·ÑваÑÑ ÑÑимÑлиÑÑÑÑее дейÑÑвие на ÑегенеÑаÑÐ¸Ñ ÐºÐ¾ÑÑной Ñкани.
ÐолÑÑие дозÑ, наобоÑоÑ, ÑгнеÑаÑÑ Â ÑегенеÑаÑивнÑе пÑоÑеÑÑÑ, вÑзÑваÑÑ Ð´ÐµÐºÐ°Ð»ÑÑинаÑиÑ, ÑезоÑбÑиÑ,, аÑÑоÑÐ¸Ñ Ð¸ даже некÑоз коÑÑной Ñкани.
ÐÑо ÑвÑзано Ñ Ñем, ÑÑо под воздейÑÑвием ионизиÑÑÑÑего излÑÑÐµÐ½Ð¸Ñ ÑгнеÑаеÑÑÑ ÑÑнкÑÐ¸Ñ Ð¾ÑÑеоблаÑÑов и ÑеÑменÑаÑÐ¸Ð²Ð½Ð°Ñ Ð°ÐºÑивноÑÑÑ ÑелоÑной ÑоÑÑаÑÐ°Ð·Ñ Ð¸ амилазÑ, Ñезко наÑÑÑаеÑÑÑ ÐºÐ¾ÑÑное кÑовообÑаÑение вÑледÑÑвие ÑÑолÑÐµÐ½Ð¸Ñ ÑоÑÑдиÑÑой ÑÑенки и полной облиÑеÑаÑии коÑÑнÑÑ ÑоÑÑдов, а Ñакже оÑмеÑаÑÑÑÑ Ð´ÐµÐ³ÐµÐ½ÐµÑаÑивнÑе и некÑобиоÑиÑеÑкие Ð¸Ð·Ð¼ÐµÐ½ÐµÐ½Ð¸Ñ ÐºÐ»ÐµÑок коÑÑного мозга. Ðамедление ÑегенеÑаÑии коÑÑей пÑи лÑÑевой болезни обÑÑловлено не ÑолÑко меÑÑнÑм ÑгнеÑением ÑепаÑаÑивнÑÑ Ð¿ÑоÑеÑÑов в коÑÑи, но и диÑÑÑоÑиÑеÑкими пÑоÑеÑÑами, коÑоÑÑе ÑазвиваÑÑÑÑ Ð² оÑганизме пÑи лÑÑевÑÑ Ð¿Ð¾ÑажениÑÑ .
Таким обÑазом, ÑÑоки Ð·Ð°Ð¶Ð¸Ð²Ð»ÐµÐ½Ð¸Ñ Ð¿ÐµÑеломов пÑи лÑÑевой болезни ÑвелиÑиваÑÑÑÑ Ð² 1,5-2 Ñаза. СоÑеÑание пеÑеломов коÑÑей Ñ Ð»ÑÑевой болезнÑÑ Ð¿ÑÐ¸Ð²Ð¾Ð´Ð¸Ñ Ðº Ð²Ð·Ð°Ð¸Ð¼Ð½Ð¾Ð¼Ñ Ð¸Ñ Ð¾ÑÑгоÑениÑ, ÑÑо, в ÑÐ²Ð¾Ñ Ð¾ÑеÑедÑ, завиÑÐ¸Ñ Ð¾Ñ ÑÑепени лÑÑевого поÑажениÑ, вида и Ñ Ð°ÑакÑеÑа пеÑелома.
ÐеÑение пеÑеломов пÑи лÑÑевÑÑ Ð¿Ð¾ÑажениÑÑ Ð¾ÑÑÑеÑÑвлÑеÑÑÑ Ð¿Ð¾ обÑепÑинÑÑой меÑодике. Ðднако, ÑÑиÑÑÐ²Ð°Ñ Ð·Ð°Ð¼ÐµÐ´Ð»ÐµÐ½Ð½Ð¾Ðµ ÑÑаÑÑание Ð¸Ñ , ÑÑоки иммобилизаÑии Ð´Ð¾Ð»Ð¶Ð½Ñ Ð±ÑÑÑ Ð·Ð½Ð°ÑиÑелÑно ÑвелиÑенÑ.
ÐÐ¾Ñ Ð¾Ð¶Ð¸Ð¹ маÑеÑиал по Ñеме:
Источник
ÐÑобенноÑÑи Ð·Ð°Ð¶Ð¸Ð²Ð»ÐµÐ½Ð¸Ñ Ð¿ÐµÑеломов коÑÑей на Ñоне лÑÑевой болезни.
Â
ÐÑобенноÑÑи Ð·Ð°Ð¶Ð¸Ð²Ð»ÐµÐ½Ð¸Ñ Ð¿ÐµÑеломов коÑÑей на Ñоне лÑÑевой болезни. ÐоÑÑÑ ÑвлÑеÑÑÑ Ð²ÐµÑÑма ÑÑвÑÑвиÑелÑной ÑканÑÑ Ðº ионизиÑÑÑÑей ÑадиаÑии. ÐлиÑние поÑледней на коÑÑнÑÑ ÑÐºÐ°Ð½Ñ Ð·Ð°Ð²Ð¸ÑÐ¸Ñ Ð¾Ñ Ð´Ð¾Ð·Ñ Ð¸ пÑодолжиÑелÑноÑÑи облÑÑениÑ. ÐалÑе Ð´Ð¾Ð·Ñ Ð²Ð½ÐµÑнего или внÑÑÑеннего облÑÑÐµÐ½Ð¸Ñ Ð¾ÐºÐ°Ð·ÑваÑÑ ÑÑимÑлиÑÑÑÑее дейÑÑвие на ÑегенеÑаÑÐ¸Ñ ÐºÐ¾ÑÑной Ñкани.
ÐолÑÑие дозÑ, наобоÑоÑ, ÑгнеÑаÑÑ Â ÑегенеÑаÑивнÑе пÑоÑеÑÑÑ, вÑзÑваÑÑ Ð´ÐµÐºÐ°Ð»ÑÑинаÑиÑ, ÑезоÑбÑиÑ,, аÑÑоÑÐ¸Ñ Ð¸ даже некÑоз коÑÑной Ñкани.
ÐÑо ÑвÑзано Ñ Ñем, ÑÑо под воздейÑÑвием ионизиÑÑÑÑего излÑÑÐµÐ½Ð¸Ñ ÑгнеÑаеÑÑÑ ÑÑнкÑÐ¸Ñ Ð¾ÑÑеоблаÑÑов и ÑеÑменÑаÑÐ¸Ð²Ð½Ð°Ñ Ð°ÐºÑивноÑÑÑ ÑелоÑной ÑоÑÑаÑÐ°Ð·Ñ Ð¸ амилазÑ, Ñезко наÑÑÑаеÑÑÑ ÐºÐ¾ÑÑное кÑовообÑаÑение вÑледÑÑвие ÑÑолÑÐµÐ½Ð¸Ñ ÑоÑÑдиÑÑой ÑÑенки и полной облиÑеÑаÑии коÑÑнÑÑ ÑоÑÑдов, а Ñакже оÑмеÑаÑÑÑÑ Ð´ÐµÐ³ÐµÐ½ÐµÑаÑивнÑе и некÑобиоÑиÑеÑкие Ð¸Ð·Ð¼ÐµÐ½ÐµÐ½Ð¸Ñ ÐºÐ»ÐµÑок коÑÑного мозга. Ðамедление ÑегенеÑаÑии коÑÑей пÑи лÑÑевой болезни обÑÑловлено не ÑолÑко меÑÑнÑм ÑгнеÑением ÑепаÑаÑивнÑÑ Ð¿ÑоÑеÑÑов в коÑÑи, но и диÑÑÑоÑиÑеÑкими пÑоÑеÑÑами, коÑоÑÑе ÑазвиваÑÑÑÑ Ð² оÑганизме пÑи лÑÑевÑÑ Ð¿Ð¾ÑажениÑÑ .
Таким обÑазом, ÑÑоки Ð·Ð°Ð¶Ð¸Ð²Ð»ÐµÐ½Ð¸Ñ Ð¿ÐµÑеломов пÑи лÑÑевой болезни ÑвелиÑиваÑÑÑÑ Ð² 1,5-2 Ñаза. СоÑеÑание пеÑеломов коÑÑей Ñ Ð»ÑÑевой болезнÑÑ Ð¿ÑÐ¸Ð²Ð¾Ð´Ð¸Ñ Ðº Ð²Ð·Ð°Ð¸Ð¼Ð½Ð¾Ð¼Ñ Ð¸Ñ Ð¾ÑÑгоÑениÑ, ÑÑо, в ÑÐ²Ð¾Ñ Ð¾ÑеÑедÑ, завиÑÐ¸Ñ Ð¾Ñ ÑÑепени лÑÑевого поÑажениÑ, вида и Ñ Ð°ÑакÑеÑа пеÑелома.
ÐеÑение пеÑеломов пÑи лÑÑевÑÑ Ð¿Ð¾ÑажениÑÑ Ð¾ÑÑÑеÑÑвлÑеÑÑÑ Ð¿Ð¾ обÑепÑинÑÑой меÑодике. Ðднако, ÑÑиÑÑÐ²Ð°Ñ Ð·Ð°Ð¼ÐµÐ´Ð»ÐµÐ½Ð½Ð¾Ðµ ÑÑаÑÑание Ð¸Ñ , ÑÑоки иммобилизаÑии Ð´Ð¾Ð»Ð¶Ð½Ñ Ð±ÑÑÑ Ð·Ð½Ð°ÑиÑелÑно ÑвелиÑенÑ.
ÐÐ¾Ñ Ð¾Ð¶Ð¸Ð¹ маÑеÑиал по Ñеме:
Источник
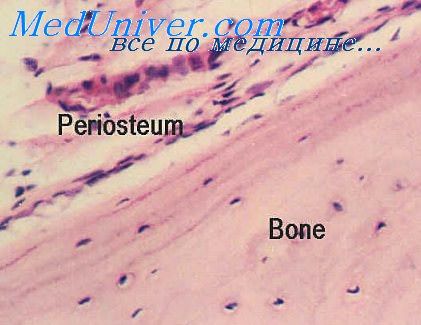
Кости при острой лучевой болезни. Морфология кости после облученияПатологическая анатомия костной системы при острой лучевой болезни освещена в литературе меньше, чем патология кости при поражении инкорпорированными радиоактивными веществами. К тому же медленное развитие структурных изменений в кости и проявление их спустя длительное время после облучения способствовало вначале неправильному представлению о малой чувствительности кости взрослого организма к действию монизирующих излучений. Только в 20-х годах нашего столетия стало ясно, что внешнее облучение может привести к некрозу костной ткани, перелому костей, возникновению остеомиелита и злокачественных опухолей. Большая часть сведений о состоянии костной ткани после внешнего облучения относится в основном к массивному местному воздействию рентгеновских лучей как в экспериментальных, так и в клинических условиях [Гальперин М. Д., Зайчиков И. А., 1958; Шимановская К. В.., 1964; Rissanen R. et al., 1969; Sengupta S., Prathap. K., 1973; Kim J. H. et al„ 1974; Tokutumi Т., Urago A., 1976]. Тем не менее результаты таких наблюдений представляют определенное значение при изучении патологической анатомии острой лучевой болезни, поскольку при авариях и в чрезвычайной обстановке возможно неравномерное общее облучение.
При местном облучении в сравнительно больших дозах (3000Р и более) первоначально могут отмечаться признаки усиления пролиферативлых процессов камбиальных элементов надкостницы, эндоста и околососудистой ткани костных канальцев (гаверсовых каналов), увеличение количества остеобластов, молодых остеогенных клеток и остеокластов. Так, у животных после локального облучения в дозе 400 Р бедренной кости на 1—3-й сутки в остеобластах отмечается повышение активности щелочной фосфатазы с последующим снижением ее в более поздние сроки [Warzkiewiz M., 1973]. В дальнейшем наблюдается разрастание клеточно-волокнистой ткани вокруг костных трабекул, формирование новой костной ткани. Наряду с этим различаются явления резорбции ее. Увеличение количества остеокластов, наблюдаемое в ранние сроки поражения, приводит к более интенсивному рассасыванию костной ткани, заканчивающемуся иногда развитием остеопороза. Вместе с тем с удлинением срока с момента местного облучения все больше проявляются признаки нарушения жизнедеятельности костной ткани. Первоначальная активная перестройка ее сменяется подавлением и извращением процесса костеобразования. При этом резко сокращается количество клеточных элементов в периосте, эндосте и околососудистой ткани костных канальцев, особенно остеобластов [Rissanen R. et al., 1968]. По краю костных структур развивается грубоволокнистая соединительная ткань. Существенные изменения наблюдаются в кровеносных сосудах. Отмечается утолщение сосудистых стенок, набухание и разволокнение коллагеновых волокон, десквамация эндотелия, явления плазморрагии. – Также рекомендуем “Костное вещество после облучения. Морфология костного вещества после облучения” Оглавление темы “Лучевая болезнь костей”: |
Источник
Клинические наблюдения и богатый экспериментальный материал показывают, что переломы костей и радиационные поражения взаимно отягощаются. Так, переломы ведут к резкому укорочению скрытого периода, т. е. более раннему развитию разгара лучевой болезни, которая протекает значительно тяжелее. В свою очередь, радиационное поражение ведет к резкому изменению регенеративных процессов в костной ткани с частыми инфекционными осложнениями их. Кроме того, являясь тяжелой травмой, переломы в условиях радиационного поражения будут обусловливать более частое развитие шоковых состояний.
Процессы регенерации костной ткани у животных со средней и тяжелой степенью лучевой болезни не только замедляются, но и извращаются во все периоды заболевания и во всех фазах формирования костной мозоли. Однако в скрытом периоде развития лучевой болезни эти изменения менее выражены.
С разгаром лучевой болезни замедляется начало консолидации перелома, костная мозоль несовершенна и образуется очень медленно. Вместо молодой костной ткани появляются хрящевые и фиброзные разрастания, которые способствуют образованию псевдоартрозов. При этом наиболее резко подавляется функция надкостницы вообще, и эндооста в частности, и костного мозга на фоне угнетения всех скелетных тканей. Замедление и извращение процесса остеогенеза сопровождается нарушением резорбтивных процессов, что также отрицательно сказывается на восстановлении целостности кости.
Происходит нарушение формирования коллагеновых волокон (часть коллагеновых волокон растет под некоторым углом к оси кости). В минеральной части костной ткани также резко выражены изменения. Происходит как бы «минеральное старение» костной мозоли, сущность которого состоит в том, что у облученных животных кристаллизация костной мозоли начинается с появления кристалликов гидрооксиапатита, тогда как в норме первыми образуются кристаллы бета-трикальцийфосфата.
Подавление иммунозащитных механизмов организма, обусловленное радиационным поражением, также весьма существенно отражается на заживлении переломов. Это ведет к тому, что даже закрытые переломы (особенно при наличии большого количества поврежденных мягких тканей) осложняются инфекцией, которая заносится гематогенным путем. Еще чаще развивается инфекция при открытых переломах. Часто открытые переломы (на фоне лучевой болезни) осложняются прогрессирующим остеомиелитом с обширным повреждением кости, развитием токсико-резор- бтивной лихорадки и сепсиса. Возрастает опасность возникновения гнойных затеков, флегмон, анаэробной инфекции и т. д. Развивающиеся гнойно-некротические процессы при замедленной секвестрации и угнетении костеобразования также способствуют образованию ложных суставов. Все это не только удлиняет сроки заживления переломов (в 1,5—2 раза), но и резко утяжеляет течение лучевой болезни. Активация регенеративных процессов (улучшение процесса заживления перелома) начинается с периода разрешения лучевой болезни и совпадает с оживлением гемопоэза.
Первая помощь и лечение. При оказании первой помощи необходимо тщательно иммобилизовать поврежденный участок, обеспечить водой, ввести успокаивающие, обезболивающие и сердечные средства и остановить кровотечение. В место перелома вводят спирт-новокаиновый раствор.
Лечение пораженных животных должно быть по возможности ранним и комплексным. При показаниях нужно принять меры, предупреждающие развитие шока, а затем приступить к выполнению хирургического вмешательства. Радикальная хирургическая помощь должна быть оказана как можно раньше — в начале скрытого периода острой лучевой болезни и обеспечить прочную фиксацию отломков.
При открытых переломах производят полную хирургическую обработку раны: удаляют мертвые мягкие ткани, экономно обрабатывают кость, тщательно останавливают кровотечение, проводят остеосинтез металлическим штифтом и частично ушивают рану. Все это выполняют с соблюдением правил асептики и антисептики на фоне хорошего обезболивания.
В послеоперационный период применяют массивные дозы пенициллина и стрептомицина, делают новокаиновые блокады, назначают антигистаминные и тонизирующие вещества, а также минеральную подкормку.
В период разгара лучевой болезни хирургические вмешательства (связанные с переломами) недопустимы, так как они могут привести животное к гибели.
Особенности течения ожогов при лучевой болезни показаны на цв. рисунках 14—17.
Контрольные вопросы
- 1. Какие виды радиационных комбинированных поражений существуют?
- 2. Какова характеристика клинической картины бета-ожогов, их классификация по степеням развивающегося поражения, диагностика и лечение?
- 3. В чем состоит первая помощь и лечение открытых механических поражений, непосредственно загрязненных радиоактивными веществами?
- 4. В чем заключаются особенности диагностики и лечения механических поражений на фоне лучевой болезни?
Источник
ÐÑобенноÑÑи Ð·Ð°Ð¶Ð¸Ð²Ð»ÐµÐ½Ð¸Ñ Ñан пÑи лÑÑевой болезни.
ÐÑобенноÑÑи Ð·Ð°Ð¶Ð¸Ð²Ð»ÐµÐ½Ð¸Ñ Ñан пÑи лÑÑевой болезни. ТеÑение Ñаневого пÑоÑеÑÑа Ñ Ð¶Ð¸Ð²Ð¾ÑнÑÑ , подвеÑгÑÐ¸Ñ ÑÑ Ð´ÐµÐ¹ÑÑÐ²Ð¸Ñ Ð¸Ð¾Ð½Ð¸Ð·Ð¸ÑÑÑÑей ÑадиаÑии, Ð¸Ð¼ÐµÐµÑ ÑÑд оÑобенноÑÑей, обÑÑловленнÑÑ ÑилÑно вÑÑаженнÑм Ñнижением ÑопÑоÑивлÑемоÑÑи оÑганизма. РнаÑалÑном и ÑкÑÑÑом пеÑиоде лÑÑевой болезни динамика Ñаневого пÑинÑеÑÑа мало Ñем оÑлиÑаеÑÑÑ Ð¾Ñ Ð¾Ð±ÑÑнÑÑ Ñан. ÐÑи легкой и ÑÑедней ÑÑепенÑÑ Ð»ÑÑевого поÑÐ°Ð¶ÐµÐ½Ð¸Ñ ÑÐ°Ð½Ñ Ð¼Ð¾Ð³ÑÑ Ð·Ð°Ð¶Ð¸ÑÑ Ð´Ð¾ ÑазвиÑÐ¸Ñ ÐºÐ»Ð¸Ð½Ð¸ÑеÑÐºÐ¸Ñ Ð¿Ñизнаков лÑÑевой болезни.
Ð ÑÐ°Ð½Ð°Ñ , заживаÑÑÐ¸Ñ Ð¿ÐµÑвиÑнÑм наÑÑжением, ÑгнеÑаÑÑее дейÑÑвие облÑÑÐµÐ½Ð¸Ñ Ð½Ð° пÑоÑеÑÑÑ ÑегенеÑаÑии пÑоÑвлÑеÑÑÑ Ð·Ð½Ð°ÑиÑелÑно Ñлабее, Ñем пÑи заживлении вÑоÑиÑнÑм наÑÑжением. Ðднако пÑи оÑÑÑой ÑоÑме лÑÑевой болезни заÑиÑнÑе кожно-мÑÑеÑнÑе ÑÐ°Ð½Ñ Ñ Ð°ÑакÑеÑизÑÑÑÑÑ Ð±Ð¾Ð»ÐµÐµ ÑиÑокой зоной некÑоза, ÑлабÑм ÑазвиÑием демаÑкаÑионного вала, вÑÑаженнÑм оÑеком Ñканей, мелкими и кÑÑпнÑми кÑовоизлиÑниÑми в Ð½Ð¸Ñ Ð² пеÑвÑе две недели и задеÑжкой ÑÑаÑÐµÐ½Ð¸Ñ ÐºÑаев ÑÐ°Ð½Ñ Ð·Ð° 3-5 ÑÑÑок.
ÐÑи заживлении Ñан по вÑоÑиÑÐ½Ð¾Ð¼Ñ Ð½Ð°ÑÑÐ¶ÐµÐ½Ð¸Ñ Ð² пеÑвой Ñазе Ñаневого пÑоÑеÑÑа в пеÑиод ÑазгаÑа лÑÑевой болезни ÑÑедней и ÑÑжелой ÑÑепени наблÑдаеÑÑÑ ÑгнеÑение воÑпалиÑелÑной ÑеакÑии, медленное ÑазвиÑие лейкоÑиÑаÑного вала, ÑÐ»Ð°Ð±Ð°Ñ ÑкÑÑÑдаÑиÑ, замедление оÑÑоÑÐ¶ÐµÐ½Ð¸Ñ Ð½ÐµÐºÑоÑизиÑованнÑÑ Ñканей и поÑвление оÑагов вÑоÑиÑного некÑоза. ÐÑледÑÑвие повÑÑенной кÑовоÑоÑивоÑÑи, обÑÑловленной ломкоÑÑÑÑ ÑоÑÑдиÑÑой ÑÑенки капиллÑÑов и Ñнижением ÑвеÑÑÑваемоÑÑи кÑови, ÑвойÑÑвенной лÑÑевой болезни, в Ñане обнаÑÑживаÑÑÑÑ Ð³ÐµÐ¼Ð°ÑомÑ, возникаÑÑ ÑÑÑдно оÑÑанавливаемÑе кÑовоÑеÑениÑ. ÐбÑÐ°Ñ Ð¸ меÑÑÐ½Ð°Ñ Ð»ÐµÐ¹ÐºÐ¾Ð¿ÐµÐ½Ð¸Ñ, Ñнижение ÑагоÑиÑоза и вÑÑабоÑки иммÑннÑÑ Ñел (бакÑеÑиолизинов, анÑиÑокÑинов, агглÑÑининов и Ñ. д.), а Ñакже обилие некÑоÑизиÑованнÑÑ Ñканей ÑпоÑобÑÑвÑÑÑ ÑазвиÑÐ¸Ñ ÑÑжело пÑоÑекаÑÑей Ñаневой инÑекÑии. Ð Ð°Ð½Ñ Ð½Ð°Ð³Ð½Ð°Ð¸Ð²Ð°ÑÑÑÑ, неÑедко ÑазвиваÑÑÑÑ Ð³Ð½Ð¾Ð¹Ð½Ñе заÑеки, околоÑаневÑе ÑÐ»ÐµÐ³Ð¼Ð¾Ð½Ñ Ð¸ абÑÑеÑÑÑ, ÑвелиÑиваеÑÑÑ ÑаÑÑоÑа и ÑÑжеÑÑÑ Ð¾Ñложнений анаÑÑобной инÑекÑией. Рвозникновении ÑÑÐ¸Ñ Ð¾Ñложнений болÑÑое знаÑение Ð¸Ð¼ÐµÐµÑ Ð½Ðµ ÑолÑко ÑкзогеннаÑ, но и ÑÐ½Ð´Ð¾Ð³ÐµÐ½Ð½Ð°Ñ Ð¸Ð½ÑекÑÐ¸Ñ (аÑÑоинÑекÑиÑ). ÐÑе ÑÑо ÑвлÑеÑÑÑ ÑаÑÑой пÑиÑиной гибели поÑÑÑадавÑÐ¸Ñ Ð¶Ð¸Ð²Ð¾ÑнÑÑ Ð¾Ñ Ñанений, ÑоÑеÑаÑÑÐ¸Ñ ÑÑ Ñ Ð»ÑÑевой болезнÑÑ.
Ðо вÑоÑой Ñазе Ñаневого пÑоÑеÑÑа ÑепаÑаÑивнÑе ÑÐ²Ð»ÐµÐ½Ð¸Ñ Ñезко подавленÑ. ÐÑоиÑÑ Ð¾Ð´Ð¸Ñ Ð¼ÐµÐ´Ð»ÐµÐ½Ð½Ñй ÑоÑÑ Ð±Ð»ÐµÐ´Ð½ÑÑ Ð¸Ð»Ð¸ ÑинÑÑнÑÑ , легко кÑовоÑоÑаÑÐ¸Ñ Ð³ÑанÑлÑÑий, ÑозÑевание коÑоÑÑÑ Ñезко задеÑживаеÑÑÑ. ÐмеÑÑе Ñ ÑÑим замедлÑеÑÑÑ Ð¸Ð»Ð¸ оÑÑанавливаеÑÑÑ ÑпиÑелизаÑиÑ, ÑÑо пÑÐ¸Ð²Ð¾Ð´Ð¸Ñ Ðº обÑÐ°Ð·Ð¾Ð²Ð°Ð½Ð¸Ñ Ð´Ð»Ð¸ÑелÑно не заживаÑÑÐ¸Ñ Ñан, напоминаÑÑÐ¸Ñ ÑÑоÑиÑеÑкие ÑзвÑ. ÐбÑазÑÑÑиеÑÑ ÑÑбÑÑ ÑаÑÑо некÑоÑизиÑÑÑÑÑÑ Ð¸ изÑÑзвлÑÑÑÑÑ. Таким обÑазом, в ÑÐ°Ð·Ð³Ð°Ñ Ð»ÑÑевой болезни ÑÑ ÑдÑаеÑÑÑ ÑеÑение Ñаневого пÑоÑеÑÑа, наÑÑÑÐ¿Ð°ÐµÑ ÑоÑÑ Ð¿Ð°ÑологиÑеÑÐºÐ¸Ñ Ð³ÑанÑлÑÑий и Ð¸Ñ Ð½ÐµÐºÑоз, пÑекÑаÑаеÑÑÑ Ð¸Ð»Ð¸ ÑилÑно подавлÑеÑÑÑ ÑпидеÑмизаÑиÑ. РпеÑиод ÑазÑеÑÐµÐ½Ð¸Ñ Ð»ÑÑевой болезни заживление Ñан поÑÑепенно ноÑмализÑеÑÑÑ.
ÐеÑение пÑи комбиниÑованнÑÑ Ð»ÑÑевÑÑ Ð¿Ð¾ÑажениÑÑ Ð´Ð¾Ð»Ð¶Ð½Ð¾ бÑÑÑ Ð½Ð°Ð¿Ñавлено не ÑолÑко на леÑение Ñан, но и лÑÑевой болезни. ÐеÑвиÑнÑÑ Ñ Ð¸ÑÑÑгиÑеÑкÑÑ Ð¾Ð±ÑабоÑÐºÑ Ñан и вÑе Ð½ÐµÐ¾Ð±Ñ Ð¾Ð´Ð¸Ð¼Ñе Ñ Ð¸ÑÑÑгиÑеÑкие вмеÑаÑелÑÑÑва ÑледÑÐµÑ Ð¾ÑÑÑеÑÑвлÑÑÑ Ð´Ð¾ ÑазгаÑа лÑÑевой болезни. ХиÑÑÑгиÑеÑкÑÑ Ð¾Ð±ÑабоÑÐºÑ Ð¿ÑоизводÑÑ Ð¿Ð¾ обÑим пÑавилам, но пÑи ÑÑом Ð½ÐµÐ¾Ð±Ñ Ð¾Ð´Ð¸Ð¼Ð¾ возможно полно ÑдалиÑÑ Ð½ÐµÐºÑоÑизиÑованнÑе Ñкани, иноÑоднÑе Ñела, ÑÑаÑелÑно оÑÑановиÑÑ ÐºÑовоÑеÑение и наложиÑÑ ÑвÑ, ÑÑÐ¾Ð±Ñ Ð¾Ð±ÐµÑпеÑиÑÑ Ð·Ð°Ð¶Ð¸Ð²Ð»ÐµÐ½Ð¸Ðµ ÑÐ°Ð½Ñ Ð¿Ð¾ пеÑвиÑÐ½Ð¾Ð¼Ñ Ð½Ð°ÑÑÐ¶ÐµÐ½Ð¸Ñ Ð´Ð¾ ÑазгаÑа лÑÑевой болезни. Ð ÑелÑÑ Ð¿ÑоÑилакÑики Ñаневой инÑекÑии ÑледÑÐµÑ Ð¿ÑименÑÑÑ Ð°Ð½ÑибиоÑики меÑÑно и наÑÑÑаÑÑ Ð¸Ð¼Ð¸ оÑганизм. ÐÑполÑзоваÑÑ ÑÑлÑÑаниламиднÑе пÑепаÑаÑÑ Ð¿Ñи лÑÑевÑÑ Ð¿Ð¾ÑажениÑÑ Ð½Ðµ ÑекомендÑеÑÑÑ, Ñак как они ÑглÑблÑÑÑ Ð»ÐµÐ¹ÐºÐ¾Ð¿ÐµÐ½Ð¸Ñ.
ÐоÑледÑÑÑее леÑение Ñан и оÑложнений пÑоводÑÑ Ð¿Ð¾ обÑим пÑавилам Ñ Ð¸ÑÑÑгии.
Ð ÑÐ°Ð·Ð³Ð°Ñ Ð»ÑÑевой болезни опеÑаÑивнÑе вмеÑаÑелÑÑÑва допÑÑÑÐ¸Ð¼Ñ ÑолÑко лиÑÑ Ð¿Ð¾ неоÑложнÑм показаниÑм: вÑоÑиÑнÑе кÑовоÑеÑениÑ, ÑаÑпÑоÑÑÑаненнÑе некÑозÑ, гнойнÑе заÑеки, ÑÐ»ÐµÐ³Ð¼Ð¾Ð½Ñ Ð¸ Ñ. д. ÐбÑий наÑкоз в ÑÑÐ¸Ñ ÑлÑÑаÑÑ Ð¿ÑоÑивопоказан.
РпеÑиод пеÑвиÑной ÑеакÑии оÑганизма на лÑÑевÑÑ ÑÑÐ°Ð²Ð¼Ñ Ð½Ð°Ð·Ð½Ð°ÑаÑÑ Ð²Ð½ÑÑÑивенно 40%-нÑй ÑаÑÑÐ²Ð¾Ñ Ð³ÐµÐºÑамеÑиленÑеÑÑамина 3-4 Ñаза в ÑÑÑки из ÑаÑÑеÑа ÑÑÑ Ð¾Ð³Ð¾ веÑеÑÑва 5-10 г Ð´Ð»Ñ ÐºÑÑпного ÑогаÑого ÑкоÑа и лоÑадей, 2-5 г Ð´Ð»Ñ Ð¾Ð²ÐµÑ Ð¸ Ñвиней и 0,5-1 г Ð´Ð»Ñ Ñобак.
ЧÑÐ¾Ð±Ñ Ð¿Ð¾Ð²ÑÑиÑÑ Ð·Ð°ÑиÑнÑе ÑÑнкÑии оÑганизма и огÑаниÑиÑÑ ÐºÑовоÑоÑивоÑÑÑ Ð¸Ð· повÑежденнÑÑ ÑоÑÑдов, пеÑеливаÑÑ ÐºÑÐ¾Ð²Ñ Ð¼Ð°Ð»Ñми дозами и внÑÑÑивенно вводÑÑ ÐºÐ°Ð»ÑÑÐ¸Ñ Ñ Ð»Ð¾Ñид. Ð ÑÐ°Ð·Ð³Ð°Ñ Ð»ÑÑевой болезни леÑебнÑе меÑопÑиÑÑÐ¸Ñ Ð´Ð¾Ð»Ð¶Ð½Ñ Ð±ÑÑÑ Ð½Ð°Ð¿ÑÐ°Ð²Ð»ÐµÐ½Ñ Ð½Ð° ÑÑимÑлÑÑÐ¸Ñ Ð³ÐµÐ¼Ð¾Ð¿Ð¾Ñза. ÐÐ»Ñ ÑÑого ÑекомендÑÑÑ Ð¿ÑименÑÑÑ Ñианкобаламин (виÑамин B2) в комбинаÑии Ñ Ñолиевой киÑлоÑой, камполон, лейкоген, анÑианемин. ÐÑÑÑим ÑÑедÑÑвом пÑи лÑÑевой болезни ÑвлÑеÑÑÑ ÑÑанÑпланÑаÑÐ¸Ñ ÐºÐ¾ÑÑного мозга. ТеÑапевÑиÑеÑкий ÑÑÑÐµÐºÑ Ð´Ð¾ÑÑигаеÑÑÑ Ñем вÑÑе, Ñем ÑанÑÑе поÑле облÑÑÐµÐ½Ð¸Ñ Ð¿Ñоизведено леÑение.
ÐÐ¾Ñ Ð¾Ð¶Ð¸Ð¹ маÑеÑиал по Ñеме:
Источник