Переломы костей при несовершенном остеогенезе
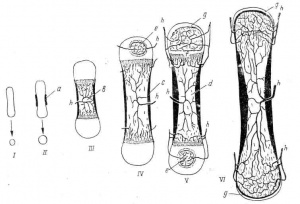
Несовершенный остеогенез – генетически обусловленная патология опорно-двигательного аппарата, характеризующаяся хрупкостью костной ткани и подверженностью ребенка частым переломам при минимальном воздействии или в отсутствие травмы. Кроме патологических переломов, при несовершенном остеогенезе у детей отмечаются деформации костей, аномалии зубов, атрофия мышц, гипермобильность суставов, прогрессирующая тугоухость. Диагноз несовершенного остеогенеза устанавливается с учетом анамнестических, клинических, рентгенологических данных, генетического тестирования. Лечение несовершенного остеогенеза включает профилактику переломов, бальнеотерапию, массаж, гимнастику, УФО, прием витамина D, препаратов кальция, фосфора, применение бисфосфонатов; при переломах – репозицию и гипсовую фиксацию отломков.
Общие сведения
Несовершенный остеогенез – наследственная патология, в основе которой лежит нарушение костеобразования (остеогенеза), приводящее к генерализованному остеопорозу и повышенной ломкости костей. Несовершенный остеогенез известен в литературе под различными названиями: врожденная хрупкость костей, внутриутробный рахит, периостальная дистрофия, болезнь Лобштейна (Фролика), врожденная остеомаляция и др. Из-за повышенной хрупкости костей и склонности к множественным переломам детей, страдающих несовершенным остеогенезом, часто называют «хрустальными детьми». Несовершенный остеогенез встречается с частотой 1 случай на 10 000-20 000 новорожденных. Несмотря на то, что как любое генетическое заболевание, несовершенный остеогенез неизлечим, сегодня существует возможность значительно облегчить и даже нормализовать жизнь «хрупких детей».
Несовершенный остеогенез
Причины несовершенного остеогенеза
Развитие несовершенного остеогенеза связано с врожденным нарушением обмена белка соединительной ткани коллагена 1-го типа, обусловленным мутациями генов, кодирующих коллагеновые цепи. В зависимости от формы заболевание может наследоваться по аутосомно-доминантному или аутосомно-рецессивному типу (менее 5%). Примерно в половине случаев патология возникает вследствие спонтанных мутаций. При несовершенном остеогенезе нарушается структура коллагена, входящего в состав костей и других соединительных тканей, либо синтезируется его недостаточное количество.
Нарушение синтеза коллагена остеобластами приводит к тому, что, несмотря на нормальный эпифизарный рост кости, нарушается периостальное и эндостальное окостенение. Костная ткань имеет пористое строение, состоит из костных островков и многочисленных пазух, заполненных рыхлой соединительной тканью; кортикальный слой истончен. Это обусловливает снижение механических свойств и патологическую ломкость костей при несовершенном остеогенезе.
Классификация несовершенного остеогенеза
Согласно классификации Д.О. Сайлленса, 1979 г., выделяют 4 генетических типа несовершенного остеогенеза:
I тип – имеет аутосомно-доминантное наследование, легкое или среднетяжелое течение. Характерны переломы умеренной тяжести, остеопороз, голубые склеры, ранняя тугоухость; несовершенный дентиногенез (подтип IA), без него – подтип IB.
II тип – предполагает аутосомно-рецессивное наследование, тяжелую перинатально-летальную форму. Оссификация черепа отсутствует, ребра имеют четкообразную форму, длинные трубчатые кости деформированы, емкость грудной клетки уменьшена. Множественные переломы костей возникают внутриутробно.
III тип – имеет аутосомно-рецессивное наследование. Протекает с тяжелой прогрессирующей деформацией костей, несовершенным дентиногенезом, переломами, развивающимися в первый год жизни.
IV тип – наследуется аутосомно-доминантным путем. Характеризуется маленьким ростом, деформацией скелета, часто переломами костей, несовершенным дентиногенезом, нормальными склерами.
В течении несовершенного остеогенеза выделяют четыре стадии: латентную стадию, стадию патологических переломов, стадию глухоты и стадию остеопороза.
Как составная часть различных наследственных синдромов, несовершенный остеогенез может сочетаться с микроцефалией и катарактой; врожденными контрактурами суставов (синдром Брука) и др.
Симптомы несовершенного остеогенеза
Манифестация и тяжесть клинических проявлений несовершенного остеогенеза зависит от генетического типа заболевания.
При внутриутробной форме несовершенного остеогенеза в большинстве случаев дети появляются на свет мертворожденными. Более 80% живых новорожденных умирает на первом месяце жизни, из них более 60% – в первые дни. У детей с фетальной формой несовершенного остеогенеза отмечаются несовместимые с жизнью внутричерепные родовые травмы, синдром дыхательных расстройств, респираторные инфекции. Характерно наличие тонкой бледной кожи, истонченной подкожной клетчатки, общей гипотонии, переломов бедренной кости, костей голени, костей предплечья, плечевой кости, реже – переломов ключицы, грудины, тел позвонков, которые могут возникать внутриутробно или в процессе родовой деятельности. Все дети с внутриутробной формой несовершенного остеогенеза обычно умирают в течение первых 2-х лет жизни.
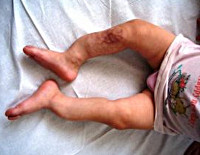
Поздняя форма несовершенного остеогенеза характеризуется типичной триадой симптомов: повышенной ломкостью костей, главным образом, нижних конечностей, синевой склер и прогрессирующей тугоухостью (глухотой). В раннем возрасте отмечается позднее закрытие родничков, отставание ребенка в физическом развитии, разболтанность суставов, атрофия мышц, подвывихи или вывихи. Переломы костей у ребенка с несовершенным остеогенезом могут возникать во время пеленания, купания, одевания ребенка, во время игр. Неправильное сращение патологических переломов часто приводит к деформации и укорочению костей конечностей. Переломы костей таза и позвоночника случаются реже. В старшем возрасте развиваются деформации грудной клетки и искривление позвоночника.
Несовершенный дентиногенез проявляется поздним прорезыванием зубов (после 1,5 лет), аномалиями прикуса; желтой окраской зубов («янтарные зубы»), их патологическим стиранием и легким разрушением, множественным кариесом. Вследствие выраженного отосклероза к 20-30 годам развиваются тугоухость и глухота. В постпубертатном периоде склонность к переломам костей уменьшается.
Сопутствующие проявления несовершенного остеогенеза могут включать пролапс митрального клапана, митральную недостаточность, чрезмерную потливость, камни в почках, пупочные и паховые грыжи, носовые кровотечения и др. Умственное и половое развитие детей при несовершенном остеогенезе не страдает.
Диагностика
Пренатальная диагностика позволяет выявить тяжелые формы несовершенного остеогенеза у плода с помощью акушерского УЗИ, начиная с 16 недели беременности. Иногда для подтверждения предположений проводится биопсия ворсин хориона и ДНК-диагностика.
В типичных случаях диагноз несовершенного остеогенеза ставится на основании клинико-анамнестических и рентгенологических данных. Обычно грубые морфологические и функциональные изменения выявляются на рентгенограммах трубчатых костей: выраженный остеопороз, истончение кортикального слоя, множественные патологические переломы с образованием костных мозолей и т. д.
Достоверность диагноза подтверждается гистоморфометрическим исследованием костной ткани, полученной во время пункции подвздошной кости, и структуры коллагена 1 типа в биоптате кожи. С целью выявления характерных для несовершенного остеогенеза мутаций выполняется молекулярно-генетический анализ.
В рамках дифференциальной диагностики несовершенного остеогенеза необходимо исключение рахита, хондродистрофии, синдрома Элерса-Данлоса.
Больные с несовершенным остеогенезом нуждаются в наблюдении детского травматолога-ортопеда, педиатра, стоматолога, детского отоларинголога, генетика.
Лечение несовершенного остеогенеза
Терапия несовершенного остеогенеза, главным образом, паллиативная, направленная на улучшение минерализации костной ткани; предотвращение переломов; физическую, психологическую и социальную реабилитацию.
Ребенку с несовершенным остеогенезом показан щадящий режим, курсы лечебной гимнастики, массажа, гидротерапии, физиотерапии (УФО, электрофорез солей кальция, индуктотермия, магнитотерапия). Из медикаментозных средств применяются поливитамины, витамин D, препараты кальция и фосфора. Для стимуляции синтеза коллагена назначается соматотропин, по завершении курса лечения которым показан прием стимуляторов минерализации костной ткани ( экстракта щитовидных желез скота, холекальциферола). Хорошие результаты при комплексной терапии несовершенного остеогенеза получены от применения бисфосфонатов, тормозящих разрушение костной ткани (памидроновой и золедроновой кислоты , ризедроната).
При переломах необходима тщательная репозиция костных отломков и гипсовая иммобилизация. При выраженных деформациях костей показано проведение хирургического лечения – корригирующей остеотомии с интрамедуллярным или накостным остеосинтезом.
Реабилитация детей, страдающих несовершенным остеогенезом, проводится группой специалистов: педиатром, детским ортопедом, физиотерапевтом, специалистом ЛФК, детским психологом и др. Детям может потребоваться ношение специальной ортопедической обуви, ортезов, стелек, корсетов.
Прогноз и профилактика
Дети с врожденной формой несовершенного остеогенеза погибают в первые месяцы и годы жизни от последствий множественных переломов и септических осложнений (пневмонии, отита, сепсиса). Поздняя форма несовершенного остеогенеза протекает более благоприятно, хотя и ограничивает качество жизни.
Профилактика сводится в основном к правильному уходу за ребенком, проведению лечебно-реабилитационных курсов, предупреждению бытовых травм. Наличие в семье больных с несовершенным остеогенезом служит прямым показанием к медико-генетическому консультированию.
Источник
 20.07.2020
20.07.2020
:
() [1-4]. , , , [5-7].
, , , [8-10].
, – , PubMed, MEDLINE, Ulrichs Periodicals Directory, cyberleninka.ru. 15 .
, , , .
, , 54- . .
, , , , [11-14]. – , , , [15, 16]. , , 0,5-1 10000 [17,18]. , COL1A1 COL1A2, , -, — , , [19-24].
– , 1979 D. Sillence et al. [25], F.H. Gloriex [26] F.S. van Dijk et al. [11]. , , 17 [27], – [28].
, , D. Sillence et al. [25], II III , , [22, 23, 24,29, 30]. , II III , , 8,4 % 27,4 % . , I IV 59,0 13,7 % [31].
C.S. Greeley et al. [32] : II , 2 % , I, III, IV 34 %, 25 %, 35 % 4 % . , , 18,0 [3] 32,0 % [31], 10 % [32].
, , [36-39]. , .. . [40], .. Bourgeois et al. [23] , , 13-14 . M.J. Marion et al. [13] 16 20 . 323 , , , 104 .
61 , , (8 ) (7 ). 17 (27,8 %) [31].
, , , , , [40, 41]. , , [1, 14, 27]. , (100 %), (80 %), (4 %), (24 %), (75 % ). , , [40, 42], [15,16]. 65 % , [43].
, – [44, 45, 46] [47].
, , , , , , [2, 23].
, , , ( ) [21, 41]. [13, 24]. , ‘ , , [48].
, . , , [24, 49, 50]. , , [42, 51]. , R. Cubert et al. [52] , 40 % , , 32 % , , . .. Chen et al. [53] . J. Ruiter-Ligeti et al. [54], 7287994 , , 295 (0,004 %) , , 75 % . , , [55], , , – [29].
‘ , , II , [25, 29, 30]. , [10, 24].
– [37, 38]. [8, 19]. : – : .
. , , 39 , . – 3740 , – 54 , – 35,5 , – 32 . : 1 – 7 , 5 – 7 .
: 9 – , 18-23 – , 23-27 – , – , 32-39 – .
. 34-35 , , , 6,5 , , (. 1, , ) (. 1, ), .
. 12-13 20-21 – – . , , .
. , – . . . , , ‘ .
( – ): , . , . , . , . . , – . , – , , . .
, . – , (. 2).
, , , . , , -, , , , .
, , : – : , III . , .
II . . . . . .
(. 3)
, , , , . ( ѻ ( ) 0,05 /).
– . . .
16 . . , , .
, , , [36, 38]. , , , . . , , , , , , [2, 13, 23, 40]. , , , . , , , . – , , ( ) .
, , , , [2, 24]. , [6, 7], .
. II III , [22]. , 34-35 .
: , , – ѻ, , , .
, , , . . , . – – [4, 13, 19, 20, 28].
1. Khan M.K., Hossain M.B. A case of brittle bone disease // Mvmensingh Med. J. 2004. Vol. 13, No 2. P.199-200.
2. Severe osteogenesis imperfecta Type-Ill and its challenging treatment in newborn and preschool children. A systematic review / J.J. Sinikumpu, M. Ojaniemi, P. Lehenkari, W. Serlo // Injury’. 2015. Vol. 46, No 8. P. 1440-1446. DOI: 10.1016/].injury.2015.04.021.
3. Yimgang D.P., Brizola E., Shapiro I.R., Health outcomes of neonates with osteogenesis imperfecta: a cross-sectional study // J. Matem. Fetal Neonatal Med. 2016. Vol. 29, No 23. P. 3889-3893. DOI: 10.31094767058.2016.1151870.
4. Collagen defects in lethal perinatal osteogenesis imperfecta / J.F. Bateman, D. Chan, T. Mascara, I.G. Rogers, W.G. Cole // Biochem. J. 1986. Vol. 240, No 3. P. 699-708.
5. (Q 78.0): / . , ; -. – (ATOP); .: .. , .. , .. . , 2013.16 .
6. .., .., .. ( ) // . 2016. 2. . 97-103. DOI 10.18019/1028-4427-2016-2-97-103.
7. Pashenko A. Results of application of intramedullary telescopic fixators in the treatment of long bone deformities of limbs in children with osteogenesis imperfect // Orthopaedics, Traumatology and Prosthetics. 2016. No 3. P. 66-72. DOI 10.15674’t)030-59872016366-72.
8. / .. , .. , .. , .. , .. // . 2011. 1. . 65-69.
9. Brittle bone disease type III in neonates – own experience / E. Jakubowska-Pietkewicz, A. Rusinska, I. Michalus, D. Chlebna-Sokol // Przegl. Lek. 2012. Vol. 69, No 4. P. 139-142.
10. Himakhun W., Rojnueangnit K., Prachukthum S. Perinatal lethal osteogenesis imperfecta in a Thai newborn: the autopsy and histopathological findings // J. Med. Assoc. Thai. 2012. Vol. 95, No Suppl. 1. P. S190-S194.
11. Classification of Osteogenesis imperfecta revisited / F.S. Van Dijk, G. Pals, R.R. van Rijn, P.G. Nikkels, J.M. Cobben/’Eur. J. Med. Genet 2010. Vol. 53, No 1. P.1-5. DOI: 10.1016 j.ejmg.2009.10.007.
12. : / .: .. , .. , .. , .. . [], 2016. URL: https7;’medi.ru klinicheskie-rekomendatsii/nesovershennyj-osteogenez_14106/*part_13. ( : 15.10.17).
13. Skeletal dysplasia in perinatal lethal osteogenesis imperfecta. A complex disorder of endochondral and intramembranous ossification/ M.J. Marion, F.H. Gannon, M.D. Fallon, M.T. Mennuti, R.F. Lodato, F.S. Kaplan !l Clin. Orthop. Relat Res. 1993. No 293. P.327-337.
14. Binder H. Rehabilitation of infants with osteogenesis imperfecta // Connect. Tissue Res. 1995. Vol. 31, No 4. P. S37-S39.
^. : , , , / .. , .. , .. , 1. Khan M.K., Hossain M.B. A case of brittle bone disease // Mvmensingh Med. J. 2004. Vol. 13, No 2. P.199-200.
2. Severe osteogenesis imperfecta Type-Ill and its challenging treatment in newborn and preschool children. A systematic review / J.J. Sinikumpu, M. Ojaniemi, P. Lehenkari, W. Serlo // Injury’. 2015. Vol. 46, No 8. P. 1440-1446. DOI: 10.1016/].injury.2015.04.021.
3. Yimgang D.P., Brizola E., Shapiro I.R., Health outcomes of neonates with osteogenesis imperfecta: a cross-sectional study // J. Matem. Fetal Neonatal Med. 2016. Vol. 29, No 23. P. 3889-3893. DOI: 10.31094767058.2016.1151870.
4. Collagen defects in lethal perinatal osteogenesis imperfecta / J.F. Bateman, D. Chan, T. Mascara, I.G. Rogers, W.G. Cole // Biochem. J. 1986. Vol. 240, No 3. P. 699-708.
5. (Q 78.0): / . , ; -. – (ATOP); .: .. , .. , .. . , 2013.16 .
6. .., .., .. ( ) // . 2016. 2. . 97-103. DOI 10.18019/1028-4427-2016-2-97-103.
7. Pashenko A. Results of application of intramedullary telescopic fixators in the treatment of long bone deformities of limbs in children with osteogenesis imperfect // Orthopaedics, Traumatology and Prosthetics. 2016. No 3. P. 66-72. DOI 10.15674’t)030-59872016366-72.
8. / .. , .. , .. , .. , .. // . 2011. 1. . 65-69.
9. Brittle bone disease type III in neonates – own experience / E. Jakubowska-Pietkewicz, A. Rusinska, I. Michalus, D. Chlebna-Sokol // Przegl. Lek. 2012. Vol. 69, No 4. P. 139-142.
10. Himakhun W., Rojnueangnit K., Prachukthum S. Perinatal lethal osteogenesis imperfecta in a Thai newborn: the autopsy and histopathological findings // J. Med. Assoc. Thai. 2012. Vol. 95, No Suppl. 1. P. S190-S194.
11. Classification of Osteogenesis imperfecta revisited / F.S. Van Dijk, G. Pals, R.R. van Rijn, P.G. Nikkels, J.M. Cobben/’Eur. J. Med. Genet 2010. Vol. 53, No 1. P.1-5. DOI: 10.1016 j.ejmg.2009.10.007.
12. : / .: .. , .. , .. , .. . [], 2016.
13. Skeletal dysplasia in perinatal lethal osteogenesis imperfecta. A complex disorder of endochondral and intramembranous ossification/ M.J. Marion, F.H. Gannon, M.D. Fallon, M.T. Mennuti, R.F. Lodato, F.S. Kaplan !l Clin. Orthop. Relat Res. 1993. No 293. P.327-337.
14. Binder H. Rehabilitation of infants with osteogenesis imperfecta // Connect. Tissue Res. 1995. Vol. 31, No 4. P. S37-S39.
15. : , , , / .. , .. , .. ,H. . , .. // . 2009. . 12, 4. . 38-48.
16. .., .., .. : // . 2015. 2 (22). . 69-73.
17. Fracture Rates and Fracture Sites in Patients With Osteogenesis Imperfecta: A Nationwide Register-Based Cohort Study / L. Folkestad, J.D. Hald, A.K. Ersbol, J. Gram, A.P. Hermann, B. Langdahl, B. Abrahamsen, K. Brixen// J. Bone Miner. Res. 2017. Vol. 32, No 1. P. 125-134. DOI: 10.100Z jbmr.2920.
18. Osteogenesis imperfect / C. Michell, V. Patel, R. Amirfeyz, M. Gargan // Curr. Orthop. 2007. Vol. 21, No 3. P. 236-241. DOI: lO.lOld’J. cuor.2007.04.003.
19. Severe osteogenesis imperfecta caused by double glvcine substitutions near the amino-terminal triple helical region in COL1A2 / M. Takagi, H. Shinohora, S. Narumi, G. Nishimura, Y. Hasegawa, T. Hasegawa//Am. J. Med. Genet A. 2015. Vol. 167, No 7. P. 1627-1631. DOI: 10.1002/ ajmg.a.37051.
20. Cheung M.S., Glorieux F.H. Osteogenesis Imperfecta: up on presentation and management H Rev. Endocr. b. Disord. 2008. Vol. 9, No 2. P. 153-160. DOI: 10.1007/sl 1154-008-9074-4.
21. The clinicopathological features of three babies with osteogenesis imperfecta resulting from the substitution of glycine by valine in the pro alpha 1 (I) chain of type I procollagen/W.G. Cole, E. Patterson, J. Bonadio, P.E. Campbell, D.W. Fortune// J. Med. Genet.1992. Vol. 29, No 2. P.112-118.
22. Prenatal diagnosis of osteogenesis imperfecta. Two cases /1. Baalbakv, S. Manouvrier, P. Dufour, L. Devismes, A. Delzenne, O. Boute, F. Puech // I. Gynecol. Obstet Biol. Reprod. 1998. Vol. 27, No 1. P. 44-51.
23. Osteogenesis imperfecta: from diagnosis and multidisciplinary treatment to future perspectives/A. Bregou Bourgeois, B. Aubrv-Rozier, L. Bonafe, L. Laurent-Applegate, D.P. Pioletti, P.Y. Zambelli // Swiss Med. Wkly. 2016. Vol. 146. P. wl4322. DOI: 10.4414/smw.2016.14322.
24. Recent developments in osteogenesis imperfecta / J.L. Shaker, C. Albert, J. Fritz, G. Harris // FlOOORes. 2015. Vol. 4, F 1000 Faculty Rev. P. 681. DOI: 10.12688/fl OOOre.6398.1.
25. Sillence D.O., Senn A., Danks D.M. Genetic heterogeneity in osteogenesis imperfecta H J. Med. Genet 1979. Vol. 16, No 2. P.101-116.
26. Glorieux F.H. Osteogenesis imperfecta // Best Pract. Res. Clin. Rheumatol. 2008. Vol. 22, No 1. P. 85-100. DOI: 10.1016 /j.berh.2007.12.012.
27. Bishop N. Characterising and treating osteogenesis imperfecta // Early Hum. Dev. 2010. Vol. 86, No 11. P. 743-746. DOI: 10.1016/j. earlhumdev.2010.08.002.
28. Van Dijk F.S., Sillence D.O. Osteogenesis imperfecta: clinical diagnosis, nomenclature and severity assessment//Am. J. Med. Genet. A. 2014. Vol. 164A, No 6. P. 1470-1481.
29. Lethal osteogenesis imperfecta in a Congolese newborn infant / G. Moven, J.L. Nkoua, M. Pongui, A.M. Mafouta, S. Nzingoula /7 Arch. Fr. Pediatr. 1993. Vol. 50, No 10. P. 891-893.
30. Perinatal lethal type II osteogenesis imperfecta: a case report/I.D. Ayadi, E.B. Hamida, R.B. Rebeh, S. Chaouachi, Z. Marrakchi // Pan Afr. Med. J. 2015. Vol. 21. P. 11.
31. : /. , .. –, .. , .. // . 2016. . 13, 1. . 44-43. DOI 10.15690/pf.vl3i 1/.514.
32. Fractures at diagnosis in infants and children with osteogenesis imperfect/ C.S. Greeley, M. Donaruma-Kwoh, M. Vettimattam, C. Lobo, C. Williard, L. Mazur//1. Pediatr. Orthop. 2013. Vol. 33, No 1. P. 32-36. DOI: 10.1097,BPO.0b013e318279c55d.
33. Neonatal clavicular fracture: recent 10 vear studv / E.S. Ahn, M.S. Jung, Y.K. Lee, S.Y. , S.M. Shin, M.H. Hahn // Pediatr. Int. 2015. Vol. 57, No 1. P. 60-63. DOI: 10.1111/ped.l2497.
34. Mane P.P., Challawar N.S., Shah H. Late presented case of distal humerus epiphyseal separation in a newborn //BMJ Case Rep. 2016. Vol. 2016. P. bcr2016215296. DOI: 10.1136/bsr-2016-215296.
35. Birth-associated femoral fractures: incidence and outcome / S. Morris, N. Cassidy, M. Stephens, D. McCormack, F. McManus// J. Pediatr. Orthop. 2002. Vol. 22, No 1. P.27-30.
36. Osteochondrodysplasias. Prenatal diagnosis and pathological-anatomic findings / C. Tennestedt, S. Bartho, R. Bollmann, A. Schwenke, I. Nitz, K. Rothe H Zentralbl. Pathol. 1993. Vol. 139, No 1. P.71-80.
37. Hackley L., Merritt L. Osteogenesis imperfecta in the neonate // . Neonatal Care. 2008. Vol. 8, No 1. P. 21-30. DOI: 10.1097/01. ANC.0000311013.71510.41.
38. Chalubinski K., Schaller A. Prenatal diagnosis of osteogenesis imperfecta. Report of a case classified as the classical Ekman Lobstein type Ultraschall. Med. 1994. Vol. 15, No 1. P. 38-42. DOI: 10.1055/s-2007-1004003.//Am. J. Med. Genet.1984. Vol. 19, No 4. P. 707-714. DOI: 10.1002/ajmg.l320190410.
40. /.. , . , .. , .. . 2009. 2 (28). . 138-140.
41. / .. , .. , .. , .. // . 2008. 2 (19). . 92-95.
42. : , /.. , .. , .. , .. -, .. , .. // . 2015. 37. . 47-51.
43. .., – .., .. , : . 2015. . 12, 5. . 579-588. DOI 10.15690/pf.vl2i5.1461.
44. / .. , .. , .. , .. -, .. //- . 2012. 3. . 67-70.
45. Infantile spinal muscular atrophy variant with congenital fractures in a female neonate: e%ridence for autosomal recessive inheritance/W. Courtens, A.B. Johansson, B. Dachy, F. Avni, N. Telerman-Toppet, H. Scheffer// J. Med. Genet. 2002. Vol. 39, No 1. P.74-77.
46. Neonatal fractures as a presenting feature of LMOD3-associated congenital myopathy / M. Abbott, M. Jain, R. Pferdehirt, Y. Chen, A. Tran, M. B. Duz, M. Seven, R.A. Gibbs, D. Muzny, B. Lee, R. Marora, L.C. Burrage//Am. J. Med. Genet. A. 2017. Vol. 173, No 10. P. 2789-2794. DOI: 10.100Z”ajmg.a.38383.
47. Lethal osteopetrosis with multiplae fractures in utero / N. el Khazen, D. Faverly, E. Vamos, N. van Regemorter, J. Flament-Durand, B. Carton, N. Cremer-Perlmutter//Am. J. Med. Genet. 1986. Vol. 23, No 3. P. 811-819. DOI: 10.100Z’ajmg.l320230308.
48. Subperiosteal new bone and callus formations in neonates with femoral shaft fracture at birth / T. Hosokawa, Y. Yamada, Y. Sato, Y. Tanami, E. Oguma // Emerg. Radiol. 2017. Vol. 24, No 2. P.143-148. DOI: 10.1007/sl0140-016-1462-6.
49. Osteogenesis imperfecta: cesarean deliveries in identical twins /. Dinges, C. Ortner, L. Bollag, J. Davies, R. Landauii Int. J. ObsteL Anesth. 2015. Vol. 24, No 1. P. 64-68.
50. Quakemack K., Beckmann M., de Moll H. Osteogenesis imperfecta in pregnancy//Geburtshilfe Frauenheilkd. 1980. Vol. 40, No 2. P. 180-184. DOI: 10.1055/S-2008-1037215.
51. Cesarean delivery is not associated with decreased at-birth fracture rates in osteogenesis imperfecta / S. Bellur, M. Jain, D. Cuthbertson, D. Krakow, J.R. Shapiro, R.D. Steiner, P.A. Smith, M.B. Bober, T. Hart, J. Krischer, M. Mullins, P.H. Byers, M. Pepin, M. Durigova, F.H. Glorieux, F. Rauch, V.R. Sutton, B. Lee, Members of the BBD Consortium, S.C. Nagamani// Genet. Med. 2016. Vol. 18, No 6. P. 570-576. DOI: 10.1038/gim.2015.131.
52. Osteogenesis imperfecta: mode of delivery and neonatal outcome / R. Cubert, E.Y. Cheng, S. Mack, M.G. Pepin, P.H. Byers // Obstet. Gvnecol. 2001. Vol. 97, No 1. P. 66-69.
53. Uncomplicated vaginal delivery in two consecutive pregnancies carried to term in a woman with osteogenesis imperfecta type I and bisphosphonate treatment before conception/ C.P Chen, S.P. Lin, Y.N. Su, J.P Huang, S.R. Chem, J.W. Su, W. Wang//Taiwan J. Oostet. Gynecol. 2012. Vol. 51, No 2. P. 305-507. DOI: 10.1016/j.tjog.2012.04.029.
54. Pregnancy outcomes in women with osteogenesis imperfecta: a retrospective cohort study / J. Ruiter-Ligeti, N. Czuzoj-Shulman, A.R. Spence, T. Tulandi, H.A. Abenhaim // J. Perinatol. 2016. Vol. 36, No 10. P. 828-831. DOI: 10.1038/jp.2016.111.
55. Anderer G., Hellmever L., Hadji P. Clinical management of a pregnant patient with type I osteogenesis imperfecta using quantitative ultrasonometry -a case report // Ultraschall. Med. 2008. Vol. 29, No 2. P. 201-204. DOI: 10.1055/s-2006-927241.
56. 6– /.. , .. , .. , .. , .. , .. , .. //, . 2017. . 5, 2. . 52-58. DOI 10.17816/PTORS5252-58.
57. / .. , .. , .. , .. , .. , .. , .. , .. , .. . 2017. . 18, N- 2 (90). . 83-86.
58. () / .-.: .. , .. , .. , .. , .. , .. , .. , .. , .. , .. , .. , .. , .. . [. .]. 40 . URL: /..,-1/1&,2017/03/ ———–.(
59. Osteogenesis imperfecta / J.C. Marini, A. Forlino, H.P. Bachinger, N.J. Bishop, PH. Byers, A. Paepe, F. Fassier, N. Fratzl-Zelman, K.M. Kozloff, D. Krakow, K. Montpetit, O. Sender//Nat. Rev. Dis. Primers. 2017. Vol. 3. P.17052. DOI: 10.1038/nrdp.2017.52.
60. Safety and efficacy of a 1-year treatment with zoledronic acid compared with pamidronate in children with osteogenesis imperfecta / E.R. Barros, G.L. Saraiva, T.P. de Oliveira, M. Lazaretti-Castro//J. Pediatr. Endocrinol. b. 2012. Vol. 25, No 5-6. P. 485-491.
1. , . . ., , , . ,
2. , , . ,
3. , 2
4. , . . ., , . , , , . ,
5. , . . ., , . , , 2
6. , . . ., , . ,
7. , . . ., 2, , . ,
8. , …, ӫ֫λ …. ,.,
:
234567 :
234567 (): 20.07.2020 15:49:00
234567 (ID): 989
234567 : , ,
12354567899
Источник
