Перелом мыщелкового отростка операция

Остеома – доброкачественная опухоль костной ткани, встречающаяся у 2,7-5,9 % больных с доброкачественными опухолями костей лица. В настоящее время высказывается предположение, что число истинных остеом существенно меньше, поскольку этот диагноз часто ошибочно выставляют при реактивной гиперплазии, экзостозах челюстей, некоторых формах фиброзной дисплазии [3, 17].
Остеомы, как правило, растут очень медленно и безболезненно, длительное время не давая о себе знать. Их клиническая картина слабовыраженна и зависит от локализации и размеров опухоли. Развиваясь в области тела нижней челюсти, остеомы приводят к деформации соответствующего участка, эстетическим и функциональным нарушениям. Остеомы верхней челюсти при значительных размерах вызывают экзофтальм, диплопию, слезотечение, нарушение носового дыхания и невралгические боли вследствие сдавления ветвей тройничного нерва. При локализации в области лобного синуса и решетчатого лабиринта опухоль способна деформировать стенки пазух, разрушать их, прорастая в орбиту и полость черепа [3, 15].
Поражение мыщелкового отростка нижней челюсти встречается довольно редко и характеризуется специфической симптоматикой. Остеомы этой локализации представляют определенную сложность для диагностики и хирургического лечения, оставаясь бессимптомными продолжительное время, однако на поздних стадиях могут являться причиной выраженных эстетических и функциональных нарушений [3, 9, 17].
Впервые остеому мыщелкового отростка подробно описал Eckert (1899), указывая на смещение нижней челюсти, нарушение открывания рта, а также изменение контуров лица на стороне поражения мыщелкового отростка нижней челюсти среди ее основных клинических проявлений [1]. В дальнейшем в литературе были представлены немногочисленные сообщения, преимущественно о единичных наблюдениях данного заболевания [1, 11, 13, 14]. Deboise А. (1981), отмечая, что остеома является наиболее частым доброкачественным новообразованием структур височно-нижнечелюстного сустава (ВНЧС), приводит лишь 3 собственных наблюдения [9]. Наибольшее число клинических наблюдений остеом мыщелкового отростка – 23 – принадлежит Х. Zhang (1997) [18]. Автор, однако, не указывает, во всех ли случаях диагноз истинной остеомы был подтвержден гистологически.
Клиническое наблюдение
Пациент К., 36 лет, история болезни № 4408 от 19.03.2004 г., поступил в челюстно-лицевое отделение № 2 ГКБ № 12 г. Киева с жалобами на деформацию лица за счет смещения нижней челюсти, нарушение прикуса, затрудненное пережевывание пищи, хруст в левом ВНЧС, умеренные болевые ощущения при повышенной нагрузке на сустав. Впервые деформацию лица – смещение подбородка вправо – отметил в ноябре 2002 года. Позднее проявилась более четкая клиническая картина, выраженность смещения и нарушение прикуса медленно прогрессировали до момента обращения. Объективно у пациента наблюдалась выраженная асимметрия лица за счет смещения нижней челюсти вправо (рис. 1).

Рис. 1. Подбородок смещен в правую сторону, состояние физиологического покоя.
В предкозелковой области четко пальпировалась смещенная латерально головка левого ВНЧС. Открывание рта – до 4,5 см, при этом отмечался хруст в области левого ВНЧС и Z-образная девиация нижней челюсти. Боковые движения челюсти вправо были ограниченны, прикус – косой, смещение средней линии вправо на 1 см (рис. 2).
Рис. 2. В предкозелковой области четко пальпируется смещенная латерально головка левого ВНЧС.
На серии рентгенограмм (ортопантомограмма, рентгенограмма нижней челюсти в прямой проекции и в укладке по Генишу слева, компьютерной томограмме области сустава с 3D-воспроизведением) определялась тень костной плотности с размером 2х1,7 см, связанная с левым мыщелковым отростком и размещающаяся в подвисочной ямке. Структуры левого ВНЧС были сохранены, хотя и несколько деформированы. При планировании оперативного вмешательства пациенту была изготовлена стереолитографическая модель черепа (рис. 3), на которой были произведены необходимые измерения и определен хирургический доступ.

Рис. 3. Стереолитографическая модель черепа, новообразование левого мыщелкового отростка нижней челюсти.
23.03.2004 пациенту проведена операция: удаление новообразования мыщелкового отростка нижней челюсти под эндотрахеальным наркозом с интубацией через нос. Для этого предушным и полувенечным доступом был обеспечен подход к скуловой дуге, которая была затем резецирована и смещена вниз на волокнах жевательной мышцы (рис. 4).
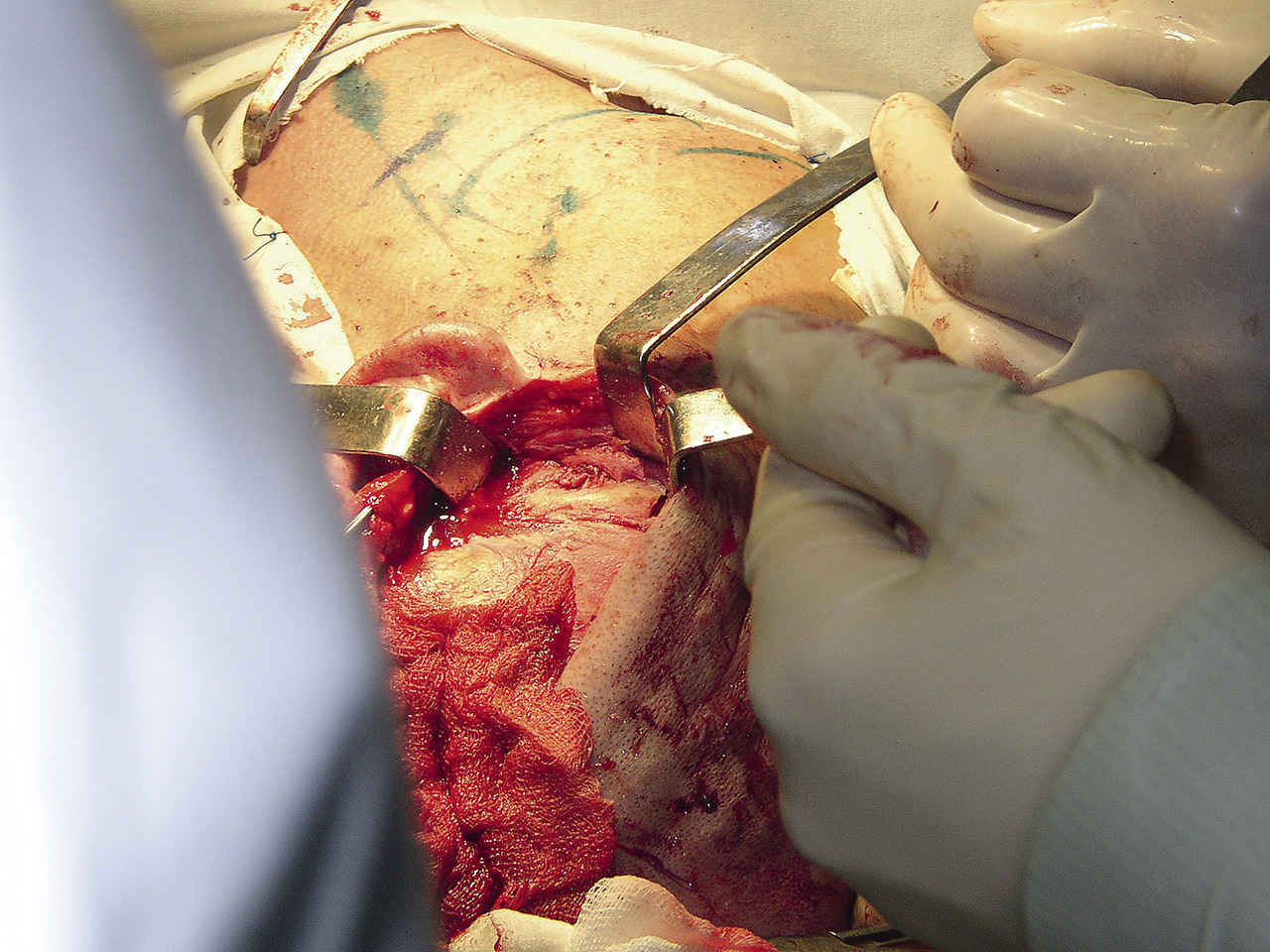
Рис. 4. Операционная рана, венечный доступ, остеотомия скуловой дуги: 1 – скуловая дуга, 2 – области остеотомий.
Волокна височной мышцы были частично пересечены и отслоены, за счет чего выполнен доступ к подвисочной ямке, где спереди и медиально от головки челюсти визуализировалось костное новообразование (рис. 5).
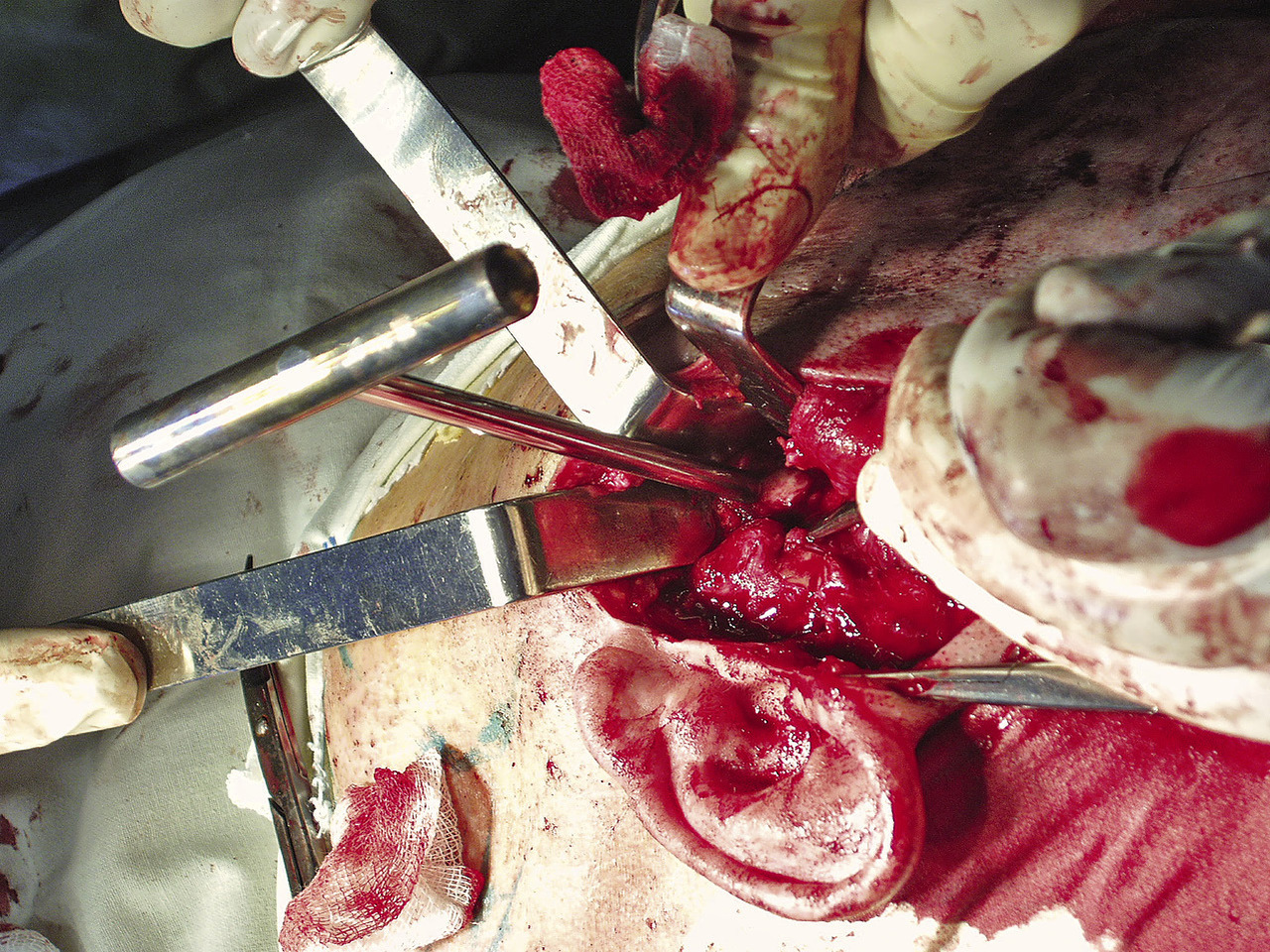
Рис. 5. Область подвисочной ямки, создан доступ к новообразованию.
Опухоль отделена от мягких тканей и фиксирована с помощью специального костного фиксатора, выполненного в виде штопора (рис. 6).
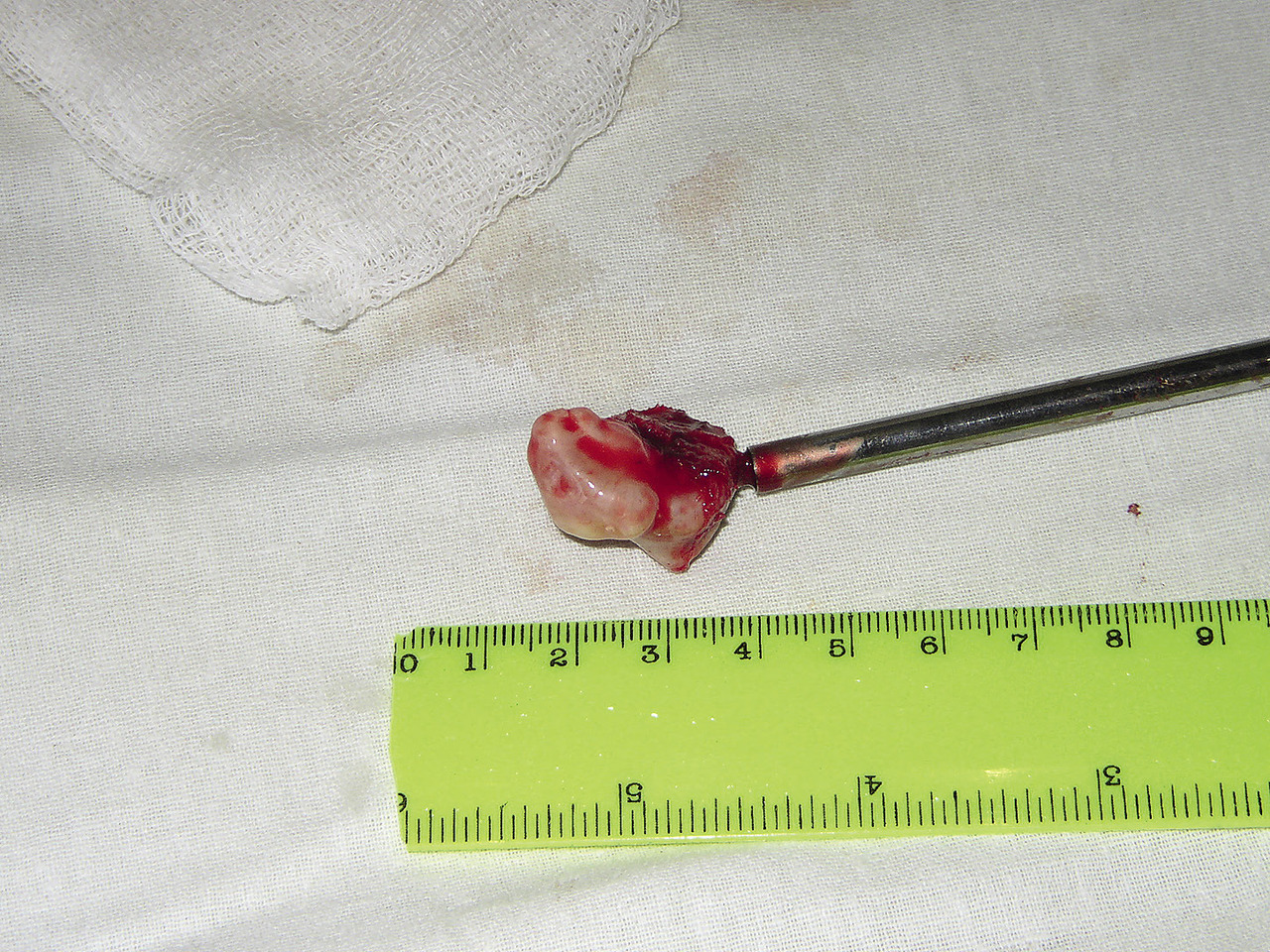
Рис. 6. Макропрепарат остеомы мыщелкового отростка нижней челюсти.
Новообразование было удалено в пределах здоровой кости. Скуловая дуга уложена на место и фиксирована двумя проволочными швами кости. Мягкотканный лоскут был уложен на место, рана послойно ушита. Послеоперационный период протекал без осложнений. Смыкание челюстей в правильном положении было отмечено на следующий день после операции без проведения каких-либо ортопедических мероприятий (рис. 7).

Рис. 7. Состояние физиологического покоя нижней челюсти на первый день после операции. Смыкание зубов в физиологическом прикусе с восстановлением средней линии.
Радикальность удаления опухоли подтверждалась данными компьютерной томографии (рис. 8).
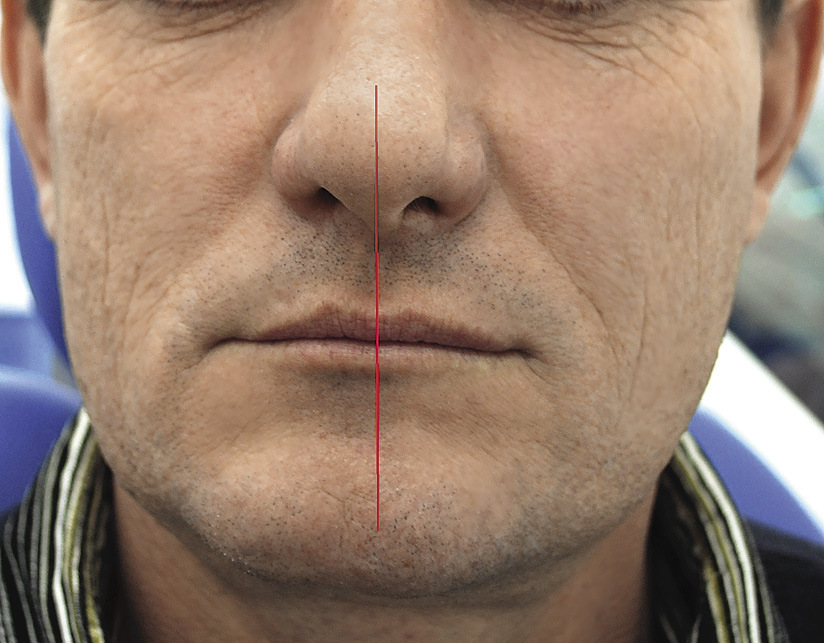
Рис.8. Симметрия лица, состояние физиологического покоя, 9 лет после операции.
Вертикальные движения нижней челюсти в полном объеме восстановились на 5-е сутки. Отмечался незначительно выраженный парез лобной и скуловой ветвей лицевого нерва, функция которых полностью восстановилась на 7-й день после операции. Послеоперационный отек височной и скуловой области удерживался 8 суток. 2.04.2004 пациент выписан в удовлетворительном состоянии с рекомендациями рационального протезирования.
16.01.2013 г. пациенту К. был проведен повторный плановый осмотр с использованием клинических и инструментальных методов исследования. Жалоб со стороны ВНЧС пациент не предъявлял. При двусторонней пальпации ВНЧС хруста и крепитации не наблюдалось, болевая симптоматика отсутствовала. Объективно: контуры лица симметричны, максимальное открывание рта – 4 см, (рис. 9, 10), средняя линия лица восстановлена, движения нижней челюсти не ограничены, без признаков латеральной девиации.
По данным ортопантомограммы и компьютерной томографии в режиме 3D-реконструкции, структурные элементы левого ВНЧС имеют четкие анатомические контуры и структуру костной ткани в пределах нормы. Соотношение мыщелкового отростка и суставной ямки обеспечивало функциональную стабильность ВНЧС и рассматривалось как приемлемое (рис. 11, 12).
Обсуждение
Локализация остеомы в области ВНЧС представляет собой редкую клиническую ситуацию. Скудность клинической симптоматики, характерная для остеом, обусловливает доминирование в клинической картине неспецифических функциональных нарушений со стороны ВНЧС, что делает необходимым проведение дифференциальной диагностики с другими заболеваниями сустава – гиперплазией ветви, деформирующим артрозом, анкилозом, внутрисуставными нарушениями, привычным вывихом и т. д.
Рентгенологические исследования в стандартных укладках являются вполне информативными для постановки правильного диагноза, однако оказываются явно недостаточными для выбора метода хирургического лечения. Для уточнения локализации новообразования с учетом изменившихся анатомических соотношений, его взаимосвязи с элементами сустава и характера структурных изменений в последнем необходимо проведение компьютерной томографии с 3D-реконструкцией. Тщательное обследование позволяет решить вопрос о дальнейшей хирургической тактике.
При переднемедиальном положении остеомы по отношению к мыщелковому отростку она располагается в области подвисочной ямки. Удаление опухоли в этом случае связано со значительными трудностями, а иногда и с риском для жизни пациента
Chen Y. (2003) утверждает, что при локализации опухоли в области суставного отростка в большинстве случаев показана его резекция с последующей артропластикой и ортопедическим лечением [8]. Этой же точки зрения придерживаются и другие авторы, рекомендуя сочетать резекцию мыщелкового отростка с последующей пластикой сустава, удлинением ветви, сочетанными операциями на верхней и нижней челюсти для коррекции прикуса и аппаратным лечением [4, 7, 18]. В то же время приведенное наблюдение свидетельствует, что в некоторых случаях возможно и даже необходимо проводить удаление опухоли с сохранением элементов сустава. Об этом также свидетельствуют данные Piattelli A. (1995) и других авторов [11, 13].
Необходимо, однако, отметить, что при переднемедиальном положении остеомы по отношению к мыщелковому отростку (по данным литературы, это наиболее типичная локализация) она располагается в области подвисочной ямки. Эта область является хирургически исключительно труднодоступной и расположена вблизи жизненно важных структур, поэтому удаление опухоли в этом случае связано со значительными трудностями, а иногда и с риском для жизни пациента.
Основными анатомическими препятствиями для достижения подвисочной ямки являются скуловая дуга, ветвь нижней челюсти, околоушная железа и лицевой нерв – образования исключительно важные в функциональном и эстетическом плане. Доступ к новообразованию должен быть достаточным для его радикального удаления и обеспечивать хороший обзор.
В настоящее время предложен ряд вариантов оперативного доступа к подвисочной ямке, в большей или меньшей степени удовлетворяющих этим требованиям, однако не все они целесообразны в случае остеомы мыщелкового отростка.
В 1961 году J. F. Barbosa разработал доступ к подвисочной ямке, который предполагал проведение разреза по Веберу – Фергюссону с последующей мобилизацией скулового комплекса и резекцией участка ветви нижней челюсти [6]. D. J. Crockett (1963), используя аналогичный доступ, ограничил резекцию ветви только венечным отростком [10, 16]. Этот так называемый передний путь, как правило, сочетается с резекцией верхней челюсти и обеспечивает широкий обзор, в то же время он является очень травматичным и неблагоприятным с косметической точки зрения. Подвисочная ямка может быть также достигнута проведением зачелюстного разреза с последующими остеотомиями ветви нижней челюсти на различном уровне, ротацией или выведением костного фрагмента из области операции. В случае резекции участка ветви последний в конце операции может быть возвращен на место и фиксирован в виде свободного аутотрансплантата [16].
Основными анатомическими препятствиями для достижения подвисочной ямки являются скуловая дуга, ветвь нижней челюсти, околоушная железа и лицевой нерв – образования исключительно важные в функциональном и эстетическом плане
В 1985 году N. R. Attenborough предложил использовать венечный доступ для визуализации структур крыло-небной и подвисочной ямки. Этот способ предполагал проведение предушного и полувенечного разрезов с последующим удалением скуловой дуги и венечного отростка [5]. H. L. Obwegeser усовершенствовал этот способ путем сочетания мобилизации всего скулового комплекса с остеотомией венечного отростка. Скуловая кость при этом смещалась книзу на волокнах жевательной мышцы, а венечный отросток отводится кверху [12]. Кроме вышеназванных, используются многочисленные модификации и комбинации доступа в зависимости от клинической ситуации [10]. Как свидетельствует наш опыт, применение венечного доступа является методом выбора при удалении опухолей, локализованных в подвисочной ямке. Он обеспечивает хороший обзор и свободу хирургических манипуляций, позволяет избежать травмы крупных сосудов и ветвей лицевого нерва, а также косметически наиболее приемлем.
Отметим также, что при длительно растущих костных опухолях в области ВНЧС сустав может претерпевать значительные морфофункциональные изменения, которые требуют послеоперационной ортопедической коррекции, однако, как было показано на примере нашего наблюдения, компенсаторные возможности сустава достаточно высоки, что в ряде случае при малотравматичном и радикальном удалении опухоли позволяет добиться восстановления функции без проведения дополнительных мероприятий в послеоперационном периоде.
Таким образом, наблюдение пациента в отдаленные сроки после операции (9 лет), свидетельствующие о безрецидивном течении и отсутствии глубоких функциональных нарушений, подтверждает эффективность использованных подходов к удалению новообразования ВНЧС. Тщательная диагностика и проведение оперативного вмешательства с использованием подходов, обеспечивающих широкий доступ к подвисочной ямке, позволили провести радикальное удаление остеомы мыщелкового отростка нижней челюсти, избегая при этом дополнительной травмы анатомических образований данной локализации, обеспечивая быстрый восстановительный послеоперационный период и удовлетворительный результат на протяжении 9 лет с полным восстановлением функции ВНЧС.
Источник
По данным Всемирной организации здравоохранения, процент переломов мыщелкового отростка нижней челюсти (МОНЧ) в структуре общего количества травматических переломов нижней челюсти составляет 35%. До 30% от этой доли приходится на переломы головки МОНЧ. Несмотря на небольшой процент встречаемости данного вида травмы, проблема лечения этой патологии остается актуальной для челюстно-лицевых хирургов как в нашей стране, так и за рубежом [1-13]. Это обусловлено сложностью клинической и рентгенологической диагностики, неоднозначностью показаний к хирургическому лечению, а также особенной сложностью хирургического вмешательства при переломах головки МОНЧ.
Стоит отметить неуклонную тенденцию к увеличению доли травматических повреждений челюстно-лицевой области в целом, и головки МОНЧ в частности, связанную с ростом дорожно-транспортного и бытового травматизма [4, 5 12, 13]. Переломы головки МОНЧ неминуемо сопряжены с повреждением других структур височно-нижнечелюстного сустава (ВНЧС), что также негативно влияет на прогноз лечения и сроки реабилитации [2]. Все вышеизложенные особенности проблемы накладывает особую ответственность на исследователей, занятых разработкой диагностики и лечения переломов головки МОНЧ.
Диагностические трудности при обследовании пациентов с подозрением на перелом головки МОНЧ связаны с тем, что использование традиционных рентгенологических методик представляет определенные трудности как на догоспитальном этапе, так и в условиях стационара. Рекомендуемые методы рентгенологической диагностики – рентгенография черепа в прямой (носолобной) проекции, рентгенография нижней челюсти в боковых проекциях, ортопантомография – не всегда позволяют диагностировать переломы головки мыщелкового отростка нижней челюсти. Так, по данным Н.А. Рабухиной, повреждения мыщелкового отростка не распознаются по обзорным снимкам почти у 25% больных [6].
В последнее время перед челюстно-лицевыми хирургами открываются новые возможности диагностики повреждений МОНЧ, связанные с активным внедрением в практику мультиспиральной компьютерной томографии (МСКТ), а также магнитно-резонансной томографии (МРТ), позволяющих с высокой степенью достоверности изучить состояние мягкотканных компонентов височно-нижнечелюстного сустава, в состав которого входит головка МОНЧ. Несмотря на указанные трудности, вопросы диагностики высоких переломов головки МОНЧ и повреждений ВНЧС в последнее десятилетие нашли свое отражение в работах отечественных исследователей, чего нельзя сказать о проблеме выбора тактики хирургического лечения [1, 2, 6].
В настоящее время трудности хирургического лечения высоких переломов МОНЧ не позволяют исследователям выработать консолидированную тактику оказания помощи пациентам с данной патологией. Ряд клиницистов, в особенности в нашей стране, придерживаются консервативной тактики лечения, в сочетании с ранней функциональной нагрузкой на поврежденный ВНЧС. Однако такой подход не может обеспечить полного анатомо-функционального восстановления структур ВНЧС, что приводит к посттравматическим нарушениям вплоть до развития анкилоза [3]. Другие исследователи отдают предпочтение хирургическому методу лечения с целью не только точной репозиции костных фрагментов головки МОНЧ, но и восстановления функционально значимых взаимоотношений мягкотканных структур ВНЧС [1-3, 7-13].
Челюстно-лицевые хирурги за последние 50 лет активно совершенствовали методики хирургического лечения переломов головки МОНЧ. Так, вплоть до 1970-х годов в качестве основной хирургической методики лечения данной патологии использовалась кондилэктомя, приводившая к выраженным функциональным нарушениям не только на стороне поражения, но и контралатерально. В.А. Малышевым была разработана методика реплантации головки МОНЧ с применением в качестве фиксатора спицы Киршнера в комбинации со стальной проволокой. В.М. Безруковым предложена методика, предусматривающая вертикальную остеотомию ветви нижней челюсти с последующим извлечением фрагмента головки МОНЧ, остеосинтез вне раны и реплантацию остеотомированного фрагмента из подчелюстного доступа [1, 2].
В различных модификациях данная методика остеосинтеза, выполняемая из подчелюстного или зачелюстного доступов, широко применяется в практике отечественных челюстно-лицевых хирургов, несмотря на отсутствие возможности полноценной визуализации внутрисуставных структур, а также риск асептического некроза реплантата.
А.А. Никитиным предложена методика замещения поврежденного (в результате перелома головки МОНЧ) ВНЧС ортотопическим аллотрансплантатом. Несмотря на хорошие результаты применения данного метода, использование его ограничено в связи со сложностью забора аллотрансплантата у спецдонора и его лабораторной подготовки, а также законодательными препятствиями, сопровождающими отечественную трансплантологию.
В своих современных работах отечественные авторы в большинстве случаев предпочитают доступ к головке МОНЧ из разреза, окаймляющего угол последней, что является по сути сочетанием подчелюстного и зачелюстного хирургических доступов, с последующей остеотомией ветви нижней челюсти и реплантацией головки МОНЧ. Данные об использовании предушного доступа к головке МОНЧ в отечественной литературе носят единичный характер, несмотря на неоспоримые преимущества подобного подхода, позволяющего в большинстве случаев отказаться от извлечения из раны малого фрагмента головки МОНЧ, что позитивно сказывается на питании последнего и снижении риска асептического некроза [2]. Ряд авторов также указывают на возможность некроза малого фрагмента ввиду отсутствия компрессии между отломками головки. С целью достижения компрессии костных фрагментов в отечественной науке в последние десятилетия активно разрабатываются фиксаторы с эффектом термомеханической памяти. Однако использование большинства существующих устройств для фиксации с эффектом памяти формы не представляется возможным без реплантации малого фрагмента головки МОНЧ [3]. В зарубежных источниках однозначно указывается на целесообразность применения предушного доступа к головке МОНЧ [12]. Также по причине отсутствия необходимой компрессии между фрагментами зарубежные авторы отказываются от применения мини- и микропластин для остеосинтеза, отдавая предпочтение винтам длиной не менее 15 мм, располагаемым по направлению от наружнего мыщелка головки МОНЧ к внутреннему [11]. Однако применение в данной методике стандартного самонарезающего винта от системы остеосинтеза «пластина – винт» не позволяет достичь достаточной силы компрессии.
Нерешенные трудности указывают на актуальность проблемы хирургического лечения переломов головки МОНЧ, заставляющую клиницистов продолжать исследования в целях улучшения результатов лечения данной патологии.
В клинике челюстно-лицевой хирургии ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского» разработана и успешно внедрена в клиническую практику новая методика остеосинтеза головки нижней челюсти.
После обработки кожи выполняется разрез в предушной области с продолжением на височную область, тупым и острым путем ткани расслаиваются до капсулы ВНЧС. Производится артротомия и расширение полости сустава инструментом, разработанным в клинике. Расширение полости ВНЧС позволяет визуализировать и репонировать смещенные фрагменты головки МОНЧ, при необходимости частично отделив ее от латеральной крыловидной мышцы. После репозиции фрагментов выполняется остеосинтез компрессионным канюлированным винтом (рис. 1). Двойная резьба компрессионного винта позволяет добиться компрессии фрагментов. Диск ВНЧС репонируется и фиксируется к тканям биламинарной зоны. Ткани ушиваются послойно. Рана дренируется.
С применением описанной методики было выполнено 15 операций. В контрольной группе из 15 пациентов выполнялась реплантация головки МОНЧ из подчелюстного доступа. Результаты оценивались в сроки 1, 3 и 6 мес. после хирургического лечения. Критерием оценки эффективности лечения служил объем физиологических движений нижней челюсти. В качестве рентгенологического контроля использовали МСКТ с анализом изменений суставной высоты, определением денситометрической плотности костной мозоли в области перелома, а также измерением размеров головки мыщелкового отростка в сравнении с ранее проведенными исследованиями (рис. 2, 3).
В контрольной группе отмечено 3 случая некроза реплантата с выраженными функциональными нарушениями: ограничением открывания рта, выраженной девиацией нижней челюсти на сторону поражения более чем на 5 мм, невозможностью полноценного приема пищи, формированием свищевых ходов на коже. В одном случае отмечено формирование анкилоза ВНЧС на 5-м месяце наблюдений. Межчелюстная фиксация, сопровождавшая все операции в контрольной группе, не позволяла проводить раннюю функциональную реабилитацию, что отразилось на сроках ограничения открывания рта, которые составили 1,5-2 мес. у всех пациентов. Дисфункция ВНЧС, проявляющаяся хрустом и болевыми ощущениями в зоне ВНЧС, отмечена у 5 пациентов. При проведении МРТ ВНЧС у данных пациентов определялся вентральный вывих диска ВНЧС без репозиции. Стойких парезов краевой ветви лицевого нерва в контрольной группе не отмечено. Сроки временного пареза достигали 3-4-х месяцев у 2-х пациентов. Рентгенологическое снижение суставной высоты более чем на 3 мм отмечено у 9 пациентов из 15 на 6-м месяце после операции, за счет уменьшения размеров головки МОНЧ в результате ее частичного лизиса.
В исследуемой группе значимой резорбции малого фрагмента головки МОНЧ не отмечено. Уменьшение суставной высоты более чем на 3 мм определялось у 4-х пациентов, что было связано с неполным ее восстановлением во время операции. При контрольных МСКТ через 1, 3 и 6 мес. этот показатель в исследуемой группе не менялся, тогда как в контрольной группе имелась тенденция к прогрессирующему уменьшению суставной высоты с течением времени. У данных пациентов отмечалась девиация нижней челюсти в сторону поражения не более чем на 2-4 мм. Отсутствие необходимости межчелюстной фиксации после операций с применением описанной методики положительно сказалось на функциональных возможностях – открывание рта на 3 см и более пациенты из исследуемой группы демонстрировали при проведении функциональных проб в сроки 1,5-2 нед. после операции. Стойких парезов лицевого нерва в исследуемой группе не отмечено.
В послеоперационном периоде пациентам проводилась активная антибактериальная терапия – внутримышечное введение антибактериальных препаратов группы линкозамидов и цефалоспоринов. Продолжительность антибактериальной терапии индивидуальна, зависит от особенностей течения послеоперационного периода и варьирует от 5 до 8 сут. В качестве противовоспалительного препарата и с целью купирования болевого синдрома в течение 5 сут после операции применялся препарат лорноксикам (Ксефокам). Из череды НПВС мы остановили свой выбор на лорноксикаме, т. к. он ингибирует ЦОГ-1 и ЦОГ-2 в сравнимых концентрациях, таким образом, индекс воздействия на данные ферменты составляет единицу. Лорноксикам повышает уровень динорфина и β-эндорфина в плазме, что говорит о центральном механизме действия. Благодаря сбалансированному ингибированию ЦОГ-1 и ЦОГ-2 Ксефокам сочетает выраженную анальгетическую и противовоспалительную активность с низким риском возникновения нежелательных явлений [14]. Влияние на механизмы воспалительной реакции определяет целесообразность применения НПВС (лорноксикама) у больных в стоматологии. Лорноксикам (Ксефокам, Ксефокам рапид) занимает важное место в алгоритме стартовой терапии острой боли; доказана эффективность и безопасность его парентерального и перорального применения, включая форму рапид. В плацебо-контролируемом слепом исследовании N. Bölükbasi et al. (2012) по изучению эффекта лорноксикама в хирургической стоматологии у больных, которым устанавливали до 3-х имплантатов в 1 квадрант, показано, что лорноксикам в форме таблеток с быстрым действием (Ксефокам рапид) позволяет адекватно контролировать интенсивность боли и демонстрирует высокий профиль безопасности в послеоперационном периоде [15].
Таким образом, оценив результаты применения предложенной методики, можно сделать вывод о ее положительных качествах, позволяющих достичь лучших функциональных результатов лечения, снизить количество осложнений, отказаться от межчелюстной фиксации, что позволяет добиваться ранней функциональной реабилитации пациентов с переломами головки мыщелкового отростка нижней челюсти.
Источник
