Перелом бедренной кости у новорожденных
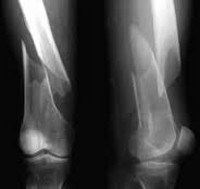
Перелом бедра у детей – достаточно распространенное травматическое повреждение. Пациенты с этой травмой составляют почти 17% от общего числа больных, госпитализируемых в детские травматологические отделения. Перелом сопровождается болью и отеком. Опора затруднена либо невозможна. Обычно наблюдается крепитация и деформация конечности, обусловленная смещением отломков, однако переломы в верхней части бедра могут сопровождаться скудной симптоматикой и по своим клиническим проявлениям напоминать ушиб мягких тканей. Диагноз выставляют на основании данных рентгенографии. Лечение обычно консервативное. На начальном этапе, как правило, используется скелетное вытяжение, затем назначается ЛФК, массаж и физиолечение. При необходимости выполняется хирургическое вмешательство.
Общие сведения
Перелом бедра у детей – это нарушение целостности бедренной кости. Обычно целостность кости нарушается полностью, но у дошкольников иногда могут выявляться повреждения «по типу зеленой ветки», когда кость ломается без повреждения надкостницы. При этом эластичная надкостница отслаивается на значительном протяжении, поэтому плохо удерживаемые ею отломки могут смещаться внутри неповрежденного периостального футляра.
Механизм переломов бедра у детей тот же, что у взрослых. Повреждение возникает вследствие падения с высоты, насильственного скручивания или перегиба конечности либо автодорожной травмы. Однако из-за особенностей анатомии и физиологии тяжесть повреждения у детей меньше зависит от силы травмы. То есть, на первый взгляд незначительная травма может стать причиной тяжелого перелома, а при значительном травматическом воздействии (например, падении с высоты) перелом может отсутствовать либо быть относительно несложным и более благоприятным в лечении.
Переломы бедренной кости у детей могут сочетаться с переломами других костей конечностей, ЧМТ, травмой грудной клетки и тупой травмой живота.
При наличии опухолевого процесса в кости (например, при остеосаркоме или метастазах в кость) возможен патологический перелом, который возникает без видимой травмы или при совсем незначительной травме.

Переломы бедренной кости у детей
Классификация переломов бедра у детей
С учетом локализации различают:
- Переломы в верхней части бедра, включающие повреждения шейки бедра, отрывы малого и большого вертела.
- Переломы диафизарной (средней) части бедренной кости.
- Переломы нижней части бедра.
Переломы диафиза являются самым тяжелым и наиболее распространенным повреждением бедренной кости и составляют 60% от общего количества переломов бедра.
С учетом особенностей повреждения различают спиральные, косые, поперечные и оскольчатые переломы. Чаще всего наблюдаются спиральные и косые переломы. Эпифизеолизы (травматические повреждения ростковой зоны) выявляются достаточно редко.
Переломы верхнего конца бедра у детей
Такие переломы разделяют на две группы. В первую (переломы шейки бедра) включают повреждения поперечника кости: эпифизеолизы головки бедра, чрезвертельные, межвертельные и чрезшеечные переломы. Во вторую – отрывы части кости без повреждения ее поперечника, то есть, апофизеолизы малого и большого вертела.
Переломы шейки бедра значительно различаются по выраженности симптоматики. При переломах со смещением появляется интенсивная боль в тазобедренном суставе. В области паха видна припухлость. Движения резко болезненны, подъем вытянутой ноги невозможен. При пальпации определяется болезненность в проекции большого вертела и области сустава. Обычно отмечается укорочение конечности.
При повреждениях кости без смещения клиника сглажена. Боли умеренные, опора на ногу сохранена. В некоторых случаях дети с такими переломами даже могут ходить. Настораживающим моментом для родителей в таких случаях становится упорный болевой синдром и некоторое разворачивание ноги кнаружи как при ходьбе, так и покое.
Для уточнения окончательного диагноза выполняется рентгенография тазобедренного сустава в стандартных проекциях. Наиболее информативен прямой снимок. При эпифизеолизах и переломах без смещения иногда требуется для сравнения сделать рентгенограмму здорового тазобедренного сустава.
Лечение осуществляется в детском травматологическом отделении. Пациентам с переломами без смещения производят вытяжение за кожу с использованием лейкопластыря и малым грузом. Ногу отводят и укладывают на шину на 2-2,5 мес. В начальном периоде показано УВЧ. После снятия вытяжения рекомендуют на 1,5 мес. ограничить нагрузку, назначают массаж, ЛФК и физиопроцедуры.
При переломах со смещением осуществляют скелетное вытяжение, также отводя ногу кнаружи. При эпифизеолизах головки срок вытяжения – 2 мес., в последующем рекомендуется разгрузка конечности сроком на 1 месяц. При вертельных и чрезшеечных переломах скелетное вытяжение длится в течение 3-4 недель. Затем на 1,5 мес. накладывают гипсовую повязку от талии до голени.
Переломы большого вертела наблюдаются редко и обычно возникают после падения на бок или удара по боковой поверхности тазобедренного сустава. Клинические проявления очень скудные. Ребенок может ходить, но жалуется на боль. Интенсивность болевого синдрома возрастает при движениях, опоре и пальпации. По наружной поверхности сустава определяется отек и кровоизлияние.
Диагноз подтверждается после сравнительной рентгенографии обоих тазобедренных суставов. Снимок здорового сустава выполняется, так как отломок вертела удерживается мышцами и практически не смещается, поэтому перелом бывает трудно распознать без сравнения со здоровым бедром. В сомнительных случаях назначают компьютерную томографию или МРТ тазобедренного сустава.
Лечение проводится детским травматологом в условиях стационара. Конечность фиксируют на 2-3 недели, накладывая лейкопластырное вытяжение с малым грузом или глубокую гипсовую повязку. Затем назначают озокерит или парафин, массаж и ЛФК.
Переломы малого вертела возникают при внезапном резком напряжении крепящихся к нему мышц и проявляются резкой болью. Боль усиливается при движениях, опоре и пальпации. Диагноз выставляют на основании рентгенограмм. Пациента госпитализируют и накладывают гипс или лейкопластырное вытяжение на 3-4 недели. После назначают озокерит, парафин, ЛФК и массаж.
Переломы диафиза бедра у детей
Переломы диафиза бедра у детей подразделяются на переломы нижней, средней и верхней трети, подвертельные переломы и надмыщелковые переломы.
Симптоматика при всех переломах бедра у детей сходная, различается лишь уровень повреждения и особенности смещения отломков вследствие тяги тех или иных мышц. При переломах в средней и верхней части бедренной кости периферический отломок смещается кнутри, центральный – в наружную сторону и кпереди.
При повреждениях в нижней части бедра мышцы оттягивают периферический отломок назад так, что иногда он разворачивается практически на 90 градусов и становится почти перпендикулярно оси конечности. Значительное смещение и наличие множества отломков может представлять угрозу вследствие возможного повреждения нервных стволов и сосудов.
Характерным симптомом является интенсивная боль. Бедро укорочено и деформировано, опора невозможна. В области повреждения выявляется припухлость, в некоторых случаях появляются кровоподтеки. Определяется патологическая подвижность, а также крепитация в месте перелома.
Единственной группой повреждений, отличающихся по выраженности перечисленных клинических проявлений, являются поднадкостничные и вколоченные переломы бедра у детей первых 2-3 лет жизни. При таких повреждениях боли незначительны, укорочение и деформация отсутствуют, опора на ногу может быть сохранена. Заподозрить перелом можно лишь по припухлости и болям в соответствующей области.
Основной метод инструментальной диагностики всех видов таких переломов – рентгенография бедра в двух проекциях. В сложных случаях назначается магнитно-резонансная томография или компьютерная томография кости. Подозрение на повреждение нервов или сосудов является основанием для консультации сосудистого хирурга, невролога или детского нейрохирурга.
Следует помнить, что диафизарные переломы бедра относятся к категории тяжелых травм и могут сопровождаться развитием шока. Пациентов с подозрением на такую травму нужно срочно доставить в мед. учреждение, предварительно дав обезболивающее и хорошо зафиксировав конечность специальной шиной или, при ее отсутствии, двумя дощечками по бокам конечности.
Лечение обычно консервативное, проводится в условиях детского травматологического отделения. Может использоваться четыре методики:
- Постоянное вытяжение до полного сращивания перелома.
- Комбинация вытяжения и иммобилизации с использованием пластиковой или гипсовой повязки. Вытяжение накладывают до образования мозоли (в среднем на 3 недели) и затем заменяют гипсовой повязкой до полного сращения.
- Иммобилизация с использованием кокситной повязки.
Выбор метода определяется особенностями переломов. Обычно применяются первая и вторая методики. Гипс без предварительного вытяжения, как правило, накладывают при поднадкостничных и вколоченных переломах.
У пациентов до 5 лет используется лейкопластырное вытяжение, у больных старшего возраста – скелетное вытяжение. Сращение, в зависимости от возраста детей и вида повреждения, наступает за 3-8 недель. Затем вытяжение снимают, разрешают дозированную нагрузку, назначают ЛФК, парафин или озокерит, а также массаж для ускорения восстановления функции конечности.
Хирургическая операция показана при невозможности обеспечить качественное вытяжение (при эпилепсии и спастических параличах), при многооскольчатых переломах и интерпозиции мягких тканей. Выполняется остеосинтез бедра блокирующим винтом. Накостные металлоконструкции обычно не применяются, поскольку у детей они могут вызвать бурное разрастание надкостницы.
Оперативное вмешательство проводится под общим наркозом. Затем пациенту накладывают гипс на 6-8 недель. В последующем назначают тепловые процедуры (озокерит, парафин), массаж и ЛФК.
Переломы нижнего конца бедра у детей
Подобные переломы бедра у детей выявляются редко и обычно возникают в школьном возрасте. Проявляются болью, гемартрозом и нарушением функции конечности. При смещении возникает выраженная деформация в верхней части колена.
Диагноз подтверждается данными рентгенографии коленного сустава. Лечение обычно консервативное, осуществляется детским травматологом в стационарных условиях. При поступлении выполняют пункцию коленного сустава. Если есть необходимость, осуществляют репозицию. Затем фиксируют конечность гипсовой повязкой. Общий срок иммобилизации – 1,5-2 мес., потом назначают ЛФК, физиотерапию и массаж.
Источник
•Ручка малыша плотно прибинтовывается к телу на 7 дней. В подмышку вкладывается небольшой валик из мягких материалов. На протяжении всего времени ношения фиксирующей повязки следят, чтобы не произошло нарушения кровообращения, то есть чтобы пальчики младенца не приобрели синюшный оттенок. Если подобное было замечено, фиксацию послабляют и накладывают менее тугую повязку.
•Если в районе ключицы обнаружена гематома, врач может назначить мазь Траумель C. Она считается одной из самых безопасных, поскольку содержит в составе 14 веществ растительного и минерального происхождения. Мазь хорошо снимает воспаление, обезболивает, убирает отечность.
•В отличие от мазей, содержащих нестероидные противовоспалительные вещества, Траумель C рекомендована для использования с рождения. Накладывают мазь как непосредственно на поврежденное место, так и в проекции по направлению к поверхности шеи и лопатки. Внутримышечно в течение трех дней ребенку вводят витамин K, чтобы убрать гематому. Запрещается спать (лежать) на больном боку. Во время кормления к груди прикладывают также только здоровой стороной. За 2 недели от перелома не остается и следа.
•Подобным образом лечится и вывих ключицы: иммобилизация конечности, наложение противовоспалительной мази Траумель C. Вывих от перелома отличают по рентгеновскому снимку.
Перелом плечевой и бедренной кости
•Перелом плечевой и бедренной костей встречается реже и является следствием
акушерских пособий при ножном или тазовом предлежании плода. Перелом в основном локализуется в середине диафиза трубчатой кости, а плоскость перелома проходит в поперечном или косом направлении. Травматические эпифизеолизы проксимальных и дистальных концов плечевой и бедренной костей встречаются чрезвычайно редко. Рентгенодиагностика затруднена из-за отсутствия ядер окостенения, что приводит к несвоевременной диагностике указанных повреждений.
•При диафизарных переломах плечевой кости обращает на себя внимание полное отсутствие движений в травмированной руке. При большом смещении отмечается патологическая
подвижность на уровне перелома, травматическая припухлость и крепитация. При обследовании больного ребенка не следует определять крепитацию отломков, так как любое движение усиливает боль и беспокоит новорожденного, а также небезопасно в отношении возможного повреждения лучевого нерва, который огибает плечевую кость в средней трети диафиза.плечевой кости.
•Переломы бедренной кости характеризуются рядом особенностей: ножка находится в типичном для новорожденного положении сгибания в коленном и тазобедренном суставах и приведена к животу вследствие физиологической гипертонии мышц-сгибателей. В то же время налицо все основные симптомы – деформация, патологическая подвижность, крепитация и травматическая припухлость. Рентгенография уточняет диагноз.
Лечение
•Различные методы лечения при диафизарных переломах представлены на рис. 55 и 56. Лечение перелома плечевой кости состоит в иммобилизации конечности сроком на 10 дней. Руку фиксируют гипсовой лонгетой от края здоровой лопатки до кисти в среднефизиологическом положении или в положении отведения плеча под углом до 90°. Картонные шины и фиксация руки к туловищу хотя и применяются при лечении переломов плечевой кости, но не гарантируют от вторичных смещений. После прекращения иммобилизации движения в травмированной конечности восстанавливаются в ближайшие 7-10 дней без дополнительных вмешательств со стороны физиотерапевта и методиста по лечебной физкультуре. С ростом ребенка происходит нивелирование оставшихся «допустимых» смещений (смещение по длине по 2-3 см, по ширине на полный поперечник кости и под углом не более 30°).
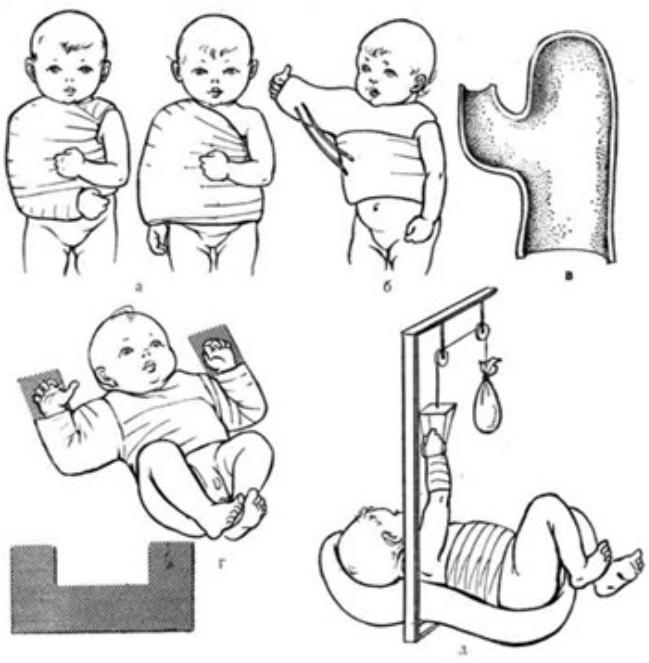
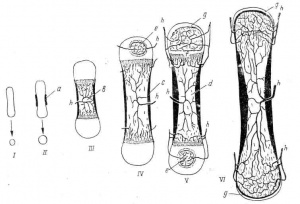
Методы лечения переломов плечевой кости у новорожденных, а – по Кеферу; б – по Марксу; в – по Фонареву; г – по Шпитци; д – по Ридену.
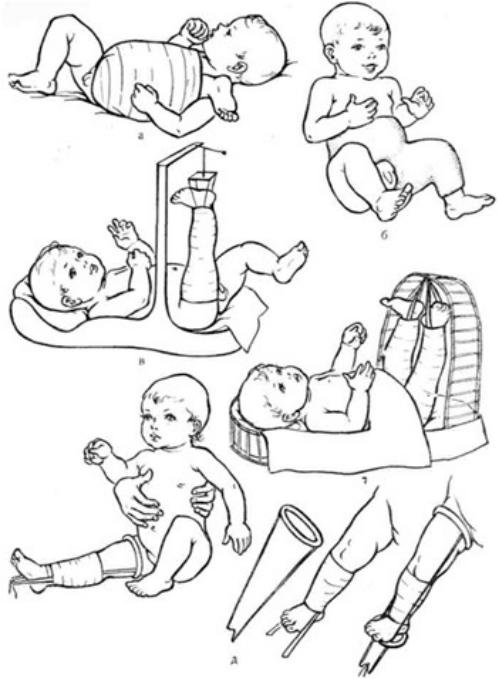
Методы лечения переломов бедренной кости у новорожденных, а – по Креде-Кеферу; б – по Павлику: в – по Ибадалеку; г – по Мадсену; д – шина Томаса (по Джонсу).
•При переломе бедренной кости у новорожденных применяют лейко- пластырное вертикальное вытяжение по Шеде. Если осуществить вытяжение по каким-либо причинам не удается, может быть применен метод Креде: травмированную ногу фиксируют мягким бинтом к туловищу ребенка. Нога полностью разогнута в коленном суставе и согнута в тазобедренном, передняя поверхность бедра при этом ложится на живот, голень- на грудь, а стопа должна доходить до надплечья. На живот и паховую область необходимо положить немного ваты во избежание опрелости.
•Через 3-5 дней повязку меняют, так как она ослабевает и необходимо контролировать положение конечности. Перелом срастается при такой фиксации в течение 2 нед. Эту повязку ребенок легко переносит и она удобна для ухода, но положение отломков далеко не всегда бывает правильным.
Травматические эпифизеолизы
плечевой кости у новорожденных
• имеют типичную картину и тем ярче выражены, чем больше смещены отломки. Характерны травматическая припухлость в области плечевого и локтевого суставов, кровоподтек и резкая боль при движении. Эпифизеолиз дистального конца плечевой кости нередко сопровождается парезом лучевого или срединного нерва. Рентгенодиагностика практически невозможна из-за отсутствия костной ткани в области эпифизов, и только к концу 7-10-го дня на повторных рентгенограммах можно увидеть костную мозоль и решить ретроспективно вопрос о характере бывшего повреждения.
• При лечении производят одномоментную репозицию с последую щей фиксацией в легкой гипсовой лонгете в среднефизиологическом положении. Через 10 дней прекращают иммобилизацию и приступают к умеренной лечебной физкультуре. Физиотерапевтическое лечение не проводят.
• Отдаленные результаты благоприятные (рис. 57 и 58).
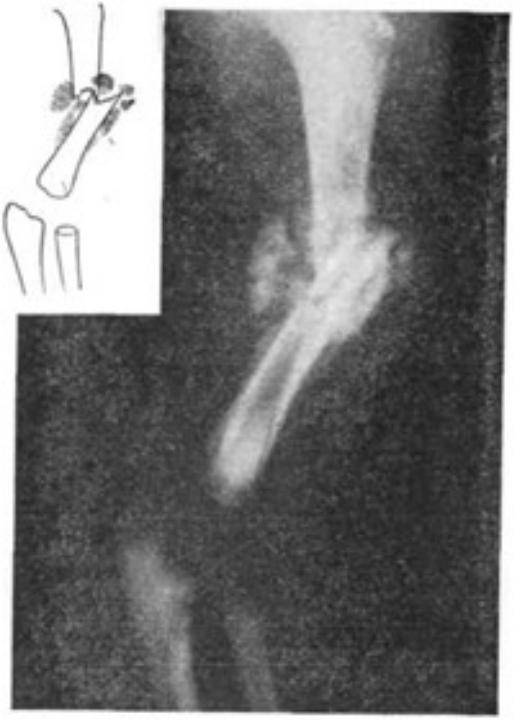
Рис. 57. Сросшийся поперечный перелом диафиза плечевой кости с угловым смещением у новорожденного. Рентгенограмма. Видна большая костная мозоль, смещение относится к категории допустимых.
Соседние файлы в предмете Перинатология
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
 20.07.2020
20.07.2020
:
() [1-4]. , , , [5-7].
, , , [8-10].
, – , PubMed, MEDLINE, Ulrichs Periodicals Directory, cyberleninka.ru. 15 .
, , , .
, , 54- . .
, , , , [11-14]. – , , , [15, 16]. , , 0,5-1 10000 [17,18]. , COL1A1 COL1A2, , -, — , , [19-24].
– , 1979 D. Sillence et al. [25], F.H. Gloriex [26] F.S. van Dijk et al. [11]. , , 17 [27], – [28].
, , D. Sillence et al. [25], II III , , [22, 23, 24,29, 30]. , II III , , 8,4 % 27,4 % . , I IV 59,0 13,7 % [31].
C.S. Greeley et al. [32] : II , 2 % , I, III, IV 34 %, 25 %, 35 % 4 % . , , 18,0 [3] 32,0 % [31], 10 % [32].
, , [36-39]. , .. . [40], .. Bourgeois et al. [23] , , 13-14 . M.J. Marion et al. [13] 16 20 . 323 , , , 104 .
61 , , (8 ) (7 ). 17 (27,8 %) [31].
, , , , , [40, 41]. , , [1, 14, 27]. , (100 %), (80 %), (4 %), (24 %), (75 % ). , , [40, 42], [15,16]. 65 % , [43].
, – [44, 45, 46] [47].
, , , , , , [2, 23].
, , , ( ) [21, 41]. [13, 24]. , ‘ , , [48].
, . , , [24, 49, 50]. , , [42, 51]. , R. Cubert et al. [52] , 40 % , , 32 % , , . .. Chen et al. [53] . J. Ruiter-Ligeti et al. [54], 7287994 , , 295 (0,004 %) , , 75 % . , , [55], , , – [29].
‘ , , II , [25, 29, 30]. , [10, 24].
– [37, 38]. [8, 19]. : – : .
. , , 39 , . – 3740 , – 54 , – 35,5 , – 32 . : 1 – 7 , 5 – 7 .
: 9 – , 18-23 – , 23-27 – , – , 32-39 – .
. 34-35 , , , 6,5 , , (. 1, , ) (. 1, ), .
. 12-13 20-21 – – . , , .
. , – . . . , , ‘ .
( – ): , . , . , . , . . , – . , – , , . .
, . – , (. 2).
, , , . , , -, , , , .
, , : – : , III . , .
II . . . . . .
(. 3)
, , , , . ( ѻ ( ) 0,05 /).
– . . .
16 . . , , .
, , , [36, 38]. , , , . . , , , , , , [2, 13, 23, 40]. , , , . , , , . – , , ( ) .
, , , , [2, 24]. , [6, 7], .
. II III , [22]. , 34-35 .
: , , – ѻ, , , .
, , , . . , . – – [4, 13, 19, 20, 28].
1. Khan M.K., Hossain M.B. A case of brittle bone disease // Mvmensingh Med. J. 2004. Vol. 13, No 2. P.199-200.
2. Severe osteogenesis imperfecta Type-Ill and its challenging treatment in newborn and preschool children. A systematic review / J.J. Sinikumpu, M. Ojaniemi, P. Lehenkari, W. Serlo // Injury’. 2015. Vol. 46, No 8. P. 1440-1446. DOI: 10.1016/].injury.2015.04.021.
3. Yimgang D.P., Brizola E., Shapiro I.R., Health outcomes of neonates with osteogenesis imperfecta: a cross-sectional study // J. Matem. Fetal Neonatal Med. 2016. Vol. 29, No 23. P. 3889-3893. DOI: 10.31094767058.2016.1151870.
4. Collagen defects in lethal perinatal osteogenesis imperfecta / J.F. Bateman, D. Chan, T. Mascara, I.G. Rogers, W.G. Cole // Biochem. J. 1986. Vol. 240, No 3. P. 699-708.
5. (Q 78.0): / . , ; -. – (ATOP); .: .. , .. , .. . , 2013.16 .
6. .., .., .. ( ) // . 2016. 2. . 97-103. DOI 10.18019/1028-4427-2016-2-97-103.
7. Pashenko A. Results of application of intramedullary telescopic fixators in the treatment of long bone deformities of limbs in children with osteogenesis imperfect // Orthopaedics, Traumatology and Prosthetics. 2016. No 3. P. 66-72. DOI 10.15674’t)030-59872016366-72.
8. / .. , .. , .. , .. , .. // . 2011. 1. . 65-69.
9. Brittle bone disease type III in neonates – own experience / E. Jakubowska-Pietkewicz, A. Rusinska, I. Michalus, D. Chlebna-Sokol // Przegl. Lek. 2012. Vol. 69, No 4. P. 139-142.
10. Himakhun W., Rojnueangnit K., Prachukthum S. Perinatal lethal osteogenesis imperfecta in a Thai newborn: the autopsy and histopathological findings // J. Med. Assoc. Thai. 2012. Vol. 95, No Suppl. 1. P. S190-S194.
11. Classification of Osteogenesis imperfecta revisited / F.S. Van Dijk, G. Pals, R.R. van Rijn, P.G. Nikkels, J.M. Cobben/’Eur. J. Med. Genet 2010. Vol. 53, No 1. P.1-5. DOI: 10.1016 j.ejmg.2009.10.007.
12. : / .: .. , .. , .. , .. . [], 2016. URL: https7;’medi.ru klinicheskie-rekomendatsii/nesovershennyj-osteogenez_14106/*part_13. ( : 15.10.17).
13. Skeletal dysplasia in perinatal lethal osteogenesis imperfecta. A complex disorder of endochondral and intramembranous ossification/ M.J. Marion, F.H. Gannon, M.D. Fallon, M.T. Mennuti, R.F. Lodato, F.S. Kaplan !l Clin. Orthop. Relat Res. 1993. No 293. P.327-337.
14. Binder H. Rehabilitation of infants with osteogenesis imperfecta // Connect. Tissue Res. 1995. Vol. 31, No 4. P. S37-S39.
^. : , , , / .. , .. , .. , 1. Khan M.K., Hossain M.B. A case of brittle bone disease // Mvmensingh Med. J. 2004. Vol. 13, No 2. P.199-200.
2. Severe osteogenesis imperfecta Type-Ill and its challenging treatment in newborn and preschool children. A systematic review / J.J. Sinikumpu, M. Ojaniemi, P. Lehenkari, W. Serlo // Injury’. 2015. Vol. 46, No 8. P. 1440-1446. DOI: 10.1016/].injury.2015.04.021.
3. Yimgang D.P., Brizola E., Shapiro I.R., Health outcomes of neonates with osteogenesis imperfecta: a cross-sectional study // J. Matem. Fetal Neonatal Med. 2016. Vol. 29, No 23. P. 3889-3893. DOI: 10.31094767058.2016.1151870.
4. Collagen defects in lethal perinatal osteogenesis imperfecta / J.F. Bateman, D. Chan, T. Mascara, I.G. Rogers, W.G. Cole // Biochem. J. 1986. Vol. 240, No 3. P. 699-708.
5. (Q 78.0): / . , ; -. – (ATOP); .: .. , .. , .. . , 2013.16 .
6. .., .., .. ( ) // . 2016. 2. . 97-103. DOI 10.18019/1028-4427-2016-2-97-103.
7. Pashenko A. Results of application of intramedullary telescopic fixators in the treatment of long bone deformities of limbs in children with osteogenesis imperfect // Orthopaedics, Traumatology and Prosthetics. 2016. No 3. P. 66-72. DOI 10.15674’t)030-59872016366-72.
8. / .. , .. , .. , .. , .. // . 2011. 1. . 65-69.
9. Brittle bone disease type III in neonates – own experience / E. Jakubowska-Pietkewicz, A. Rusinska, I. Michalus, D. Chlebna-Sokol // Przegl. Lek. 2012. Vol. 69, No 4. P. 139-142.
10. Himakhun W., Rojnueangnit K., Prachukthum S. Perinatal lethal osteogenesis imperfecta in a Thai newborn: the autopsy and histopathological findings // J. Med. Assoc. Thai. 2012. Vol. 95, No Suppl. 1. P. S190-S194.
11. Classification of Osteogenesis imperfecta revisited / F.S. Van Dijk, G. Pals, R.R. van Rijn, P.G. Nikkels, J.M. Cobben/’Eur. J. Med. Genet 2010. Vol. 53, No 1. P.1-5. DOI: 10.1016 j.ejmg.2009.10.007.
12. : / .: .. , .. , .. , .. . [], 2016.
13. Skeletal dysplasia in perinatal lethal osteogenesis imperfecta. A complex disorder of endochondral and intramembranous ossification/ M.J. Marion, F.H. Gannon, M.D. Fallon, M.T. Mennuti, R.F. Lodato, F.S. Kaplan !l Clin. Orthop. Relat Res. 1993. No 293. P.327-337.
14. Binder H. Rehabilitation of infants with osteogenesis imperfecta // Connect. Tissue Res. 1995. Vol. 31, No 4. P. S37-S39.
15. : , , , / .. , .. , .. ,H. . , .. // . 2009. . 12, 4. . 38-48.
16. .., .., .. : // . 2015. 2 (22). . 69-73.
17. Fracture Rates and Fracture Sites in Patients With Osteogenesis Imperfecta: A Nationwide Register-Based Cohort Study / L. Folkestad, J.D. Hald, A.K. Ersbol, J. Gram, A.P. Hermann, B. Langdahl, B. Abrahamsen, K. Brixen// J. Bone Miner. Res. 2017. Vol. 32, No 1. P. 125-134. DOI: 10.100Z jbmr.2920.
18. Osteogenesis imperfect / C. Michell, V. Patel, R. Amirfeyz, M. Gargan // Curr. Orthop. 2007. Vol. 21, No 3. P. 236-241. DOI: lO.lOld’J. cuor.2007.04.003.
19. Severe osteogenesis imperfecta caused by double glvcine substitutions near the amino-terminal triple helical region in COL1A2 / M. Takagi, H. Shinohora, S. Narumi, G. Nishimura, Y. Hasegawa, T. Hasegawa//Am. J. Med. Genet A. 2015. Vol. 167, No 7. P. 1627-1631. DOI: 10.1002/ ajmg.a.37051.
20. Cheung M.S., Glorieux F.H. Osteogenesis Imperfecta: up on presentation and management H Rev. Endocr. b. Disord. 2008. Vol. 9, No 2. P. 153-160. DOI: 10.1007/sl 1154-008-9074-4.
21. The clinicopathological features of three babies with osteogenesis imperfecta resulting from the substitution of glycine by valine in the pro alpha 1 (I) chain of type I procollagen/W.G. Cole, E. Patterson, J. Bonadio, P.E. Campbell, D.W. Fortune// J. Med. Genet.1992. Vol. 29, No 2. P.112-118.
22. Prenatal diagnosis of osteogenesis imperfecta. Two cases /1. Baalbakv, S. Manouvrier, P. Dufour, L. Devismes, A. Delzenne, O. Boute, F. Puech // I. Gynecol. Obstet Biol. Reprod. 1998. Vol. 27, No 1. P. 44-51.
23. Osteogenesis imperfecta: from diagnosis and multidisciplinary treatment to future perspectives/A. Bregou Bourgeois, B. Aubrv-Rozier, L. Bonafe, L. Laurent-Applegate, D.P. Pioletti, P.Y. Zambelli // Swiss Med. Wkly. 2016. Vol. 146. P. wl4322. DOI: 10.4414/smw.2016.14322.
24. Recent developments in osteogenesis imperfecta / J.L. Shaker, C. Albert, J. Fritz, G. Harris // FlOOORes. 2015. Vol. 4, F 1000 Faculty Rev. P. 681. DOI: 10.12688/fl OOOre.6398.1.
25. Sillence D.O., Senn A., Danks D.M. Genetic heterogeneity in osteogenesis imperfecta H J. Med. Genet 1979. Vol. 16, No 2. P.101-116.
26. Glorieux F.H. Osteogenesis imperfecta // Best Pract. Res. Clin. Rheumatol. 2008. Vol. 22, No 1. P. 85-100. DOI: 10.1016 /j.berh.2007.12.012.
27. Bishop N. Characterising and treating osteogenesis imperfecta // Early Hum. Dev. 2010. Vol. 86, No 11. P. 743-746. DOI: 10.1016/j. earlhumdev.2010.08.002.
28. Van Dijk F.S., Sillence D.O. Osteogenesis imperfecta: clinical diagnosis, nomenclature and severity assessment//Am. J. Med. Genet. A. 2014. Vol. 164A, No 6. P. 1470-1481.
29. Lethal osteogenesis imperfecta in a Congolese newborn infant / G. Moven, J.L. Nkoua, M. Pongui, A.M. Mafouta, S. Nzingoula /7 Arch. Fr. Pediatr. 1993. Vol. 50, No 10. P. 891-893.
30. Perinatal lethal type II osteogenesis imperfecta: a case report/I.D. Ayadi, E.B. Hamida, R.B. Rebeh, S. Chaouachi, Z. Marrakchi // Pan Afr. Med. J. 2015. Vol. 21. P. 11.
31. : /. , .. –, .. , .. // . 2016. . 13, 1. . 44-43. DOI 10.15690/pf.vl3i 1/.514.
32. Fractures at diagnosis in infants and children with osteogenesis imperfect/ C.S. Greeley, M. Donaruma-Kwoh, M. Vettimattam, C. Lobo, C. Williard, L. Mazur//1. Pediatr. Orthop. 2013. Vol. 33, No 1. P. 32-36. DOI: 10.1097,BPO.0b013e318279c55d.
33. Neonatal clavicular fracture: recent 10 vear studv / E.S. Ahn, M.S. Jung, Y.K. Lee, S.Y. , S.M. Shin, M.H. Hahn // Pediatr. Int. 2015. Vol. 57, No 1. P. 60-63. DOI: 10.1111/ped.l2497.
34. Mane P.P., Challawar N.S., Shah H. Late presented case of distal humerus epiphyseal separation in a newborn //BMJ Case Rep. 2016. Vol. 2016. P. bcr2016215296. DOI: 10.1136/bsr-2016-215296.
35. Birth-associated femoral fractures: incidence and outcome / S. Morris, N. Cassidy, M. Stephens, D. McCormack, F. McManus// J. Pediatr. Orthop. 2002. Vol. 22, No 1. P.27-30.
36. Osteochondrodysplasias. Prenatal diagnosis and pathological-anatomic findings / C. Tennestedt, S. Bartho, R. Bollmann, A. Schwenke, I. Nitz, K. Rothe H Zentralbl. Pathol. 1993. Vol. 139, No 1. P.71-80.
37. Hackley L., Merritt L. Osteogenesis imperfecta in the neonate // . Neonatal Care. 2008. Vol. 8, No 1. P. 21-30. DOI: 10.1097/01. ANC.0000311013.71510.41.
38. Chalubinski K., Schaller A. Prenatal diagnosis of osteogenesis imperfecta. Report of a case classified as the classical Ekman Lobstein type Ultraschall. Med. 1994. Vol. 15, No 1. P. 38-42. DOI: 10.1055/s-2007-1004003.//Am. J. Med. Genet.1984. Vol. 19, No 4. P. 707-714. DOI: 10.1002/ajmg.l320190410.
40. /.. , . , .. , .. . 2009. 2 (28). . 138-140.
41. / .. , .. , .. , .. // . 2008. 2 (19). . 92-95.
42. : , /.. , .. , .. , .. -, .. , .. // . 2015. 37. . 47-51.
43. .., – .., .. , : . 2015. . 12, 5. . 579-588. DOI 10.15690/pf.vl2i5.1461.
44. / .. , .. , .. , .. -, .. //- . 2012. 3. . 67-70.
45. Infantile spinal muscular atrophy variant with congenital fractures in a female neonate: e%ridence for autosomal recessive inheritance/W. Courtens, A.B. Johansson, B. Dachy, F. Avni, N. Telerman-Toppet, H. Scheffer// J. Med. Genet. 2002. Vol. 39, No 1. P.74-77.
46. Neonatal fractures as a presenting feature of LMOD3-associated congenital myopathy / M. Abbott, M. Jain, R. Pferdehirt, Y. Chen, A. Tran, M. B. Duz, M. Seven, R.A. Gibbs, D. Muzny, B. Lee, R. Marora, L.C. Burrage//Am. J. Med. Genet. A. 2017. Vol. 173, No 10. P. 2789-2794. DOI: 10.100Z”ajmg.a.38383.
47. Lethal osteopetrosis with multiplae fractures in utero / N. el Khazen, D. Faverly, E. Vamos, N. van Regemorter, J. Flament-Durand, B. Carton, N. Cremer-Perlmutter//Am. J. Med. Genet. 1986. Vol. 23, No 3. P. 811-819. DOI: 10.100Z’ajmg.l320230308.
48. Subperiosteal new bone and callus formations in neonates with femoral shaft fracture at birth / T. Hosokawa, Y. Yamada, Y. Sato, Y. Tanami, E. Oguma // Emerg. Radiol. 2017. Vol. 24, No 2. P.143-148. DOI: 10.1007/sl0140-016-1462-6.
49. Osteogenesis imperfecta: cesarean deliveries in identical twins /. Dinges, C. Ortner, L. Bollag, J. Davies, R. Landauii Int. J. ObsteL Anesth. 2015. Vol. 24, No 1. P. 64-68.
50. Quakemack K., Beckmann M., de Moll H. Osteogenesis imperfecta in pregnancy//Geburtshilfe Frauenheilkd. 1980. Vol. 40, No 2. P. 180-184. DOI: 10.1055/S-2008-1037215.
51. Cesarean delivery is not associated with decreased at-birth fracture rates in osteogenesis imperfecta / S. Bellur, M. Jain, D. Cuthbertson, D. Krakow, J.R. Shapiro, R.D. Steiner, P.A. Smith, M.B. Bober, T. Hart, J. Krischer, M. Mullins, P.H. Byers, M. Pepin, M. Durigova, F.H. Glorieux, F. Rauch, V.R. Sutton, B. Lee, Members of the BBD Consortium, S.C. Nagamani// Genet. Med. 2016. Vol. 18, No 6. P. 570-576. DOI: 10.1038/gim.2015.131.
52. Osteogenesis imperfecta: mode of delivery and neonatal outcome / R. Cubert, E.Y. Cheng, S. Mack, M.G. Pepin, P.H. Byers // Obstet. Gvnecol. 2001. Vol. 97, No 1. P. 66-69.
53. Uncomplicated vaginal delivery in two consecutive pregnancies carried to term in a woman with osteogenesis imperfecta type I and bisphosphonate treatment before conception/ C.P Chen, S.P. Lin, Y.N. Su, J.P Huang, S.R. Chem, J.W. Su, W. Wang//Taiwan J. Oostet. Gynecol. 2012. Vol. 51, No 2. P. 305-507. DOI: 10.1016/j.tjog.2012.04.029.
54. Pregnancy outcomes in women with osteogenesis imperfecta: a retrospective cohort study / J. Ruiter-Ligeti, N. Czuzoj-Shulman, A.R. Spence, T. Tulandi, H.A. Abenhaim // J. Perinatol. 2016. Vol. 36, No 10. P. 828-831. DOI: 10.1038/jp.2016.111.
55. Anderer G., Hellmever L., Hadji P. Clinical management of a pregnant patient with type I osteogenesis imperfecta using quantitative ultrasonometry -a case report // Ultraschall. Med. 2008. Vol. 29, No 2. P. 201-204. DOI: 10.1055/s-2006-927241.
56. 6– /.. , .. , .. , .. , .. , .. , .. //, . 2017. . 5, 2. . 52-58. DOI 10.17816/PTORS5252-58.
57. / .. , .. , .. , .. , .. , .. , .. , .. , .. . 2017. . 18, N- 2 (90). . 83-86.
58. () / .-.: .. , .. , .. , .. , .. , .. , .. , .. , .. , .. , .. , .. , .. . [. .]. 40 . URL: /..,-1/1&,2017/03/ ———–.(
59. Osteogenesis imperfecta / J.C. Marini, A. Forlino, H.P. Bachinger, N.J. Bishop, PH. Byers, A. Paepe, F. Fassier, N. Fratzl-Zelman, K.M. Kozloff, D. Krakow, K. Montpetit, O. Sender//Nat. Rev. Dis. Primers. 2017. Vol. 3. P.17052. DOI: 10.1038/nrdp.2017.52.
60. Safety and efficacy of a 1-year treatment with zoledronic acid compared with pamidronate in children with osteogenesis imperfecta / E.R. Barros, G.L. Saraiva, T.P. de Oliveira, M. Lazaretti-Castro//J. Pediatr. Endocrinol. b. 2012. Vol. 25, No 5-6. P. 485-491.
1. , . . ., , , . ,
2. , , . ,
3. , 2
4. , . . ., , . , , , . ,
5. , . . ., , . , , 2
6. , . . ., , . ,
7. , . . ., 2, , . ,
8. , …, ӫ֫λ …. ,.,
:
234567 :
234567 (): 20.07.2020 15:49:00
234567 (ID): 989
234567 : , ,
12354567899
Источник
