Notch сигнальный путь и заживление переломов кости

- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Кутузова Л.А. 1 Меметова А.А. 1 Силиверст О.Н. 1
1 Медицинская академия им.С.И.Георгиевского ФГАОУ ВО “КФУ им. В.И Вернадского”
В начале предыдущего столетия были открыты рецепторы-белки Notch, играющие одну из ведущих ролей в процессах эмбрионального развития живого организма. Данные высокомолекулярные органические соединения представлены у млекопитающих, в том числе и человека, четырьмя типами огромных молекул-димеров, способных при помощи уникального механизма запускать сигнал каскадных реакций, который влияет на выбор клеткой своего жизненного пути. Такое взаимодействие обеспечивается за счет наличия высокоспецифичных лигандов семейств Jagged, DLL и DSL, контакт с которыми инициирует протеолиз внутриклеточного домена рецептора, транслокацию его в ядро и активирует транскрипцию генов, ответственных за равновесие между пролиферацией, аппоптозом и дифференцировкой. Помимо этого, белки Notch регулируют жизнедеятельность уже дифференцированных клеток, таким образом поддерживая постоянство некоторых характеристик уже сформированных, обособленных друг от друга тканей. Наиболее изучена роль белков Notch в процессах гемопоэза, сомато- и нейрогенеза. Различного рода нарушения, возникающие в ходе активации сигнального пути Notch, служат причиной разнородных дефектов осевых органов, в том числе принимают участие в течении канцерогенеза. Однако, будут ли белки Notch выступать в качестве опухолевого супрессора или же наоборот, стимулировать деление раковых клеток, зависит от микроокружения белков-рецепторов. Статья посвящена пристальному анализу данных о строении белков семейства Notch и их лигандов, канонической активации сигнального Notch-пути, воздействии такого биомеханизма на клетку, а также освещению факторов, влияние которых определяет конечный путь развития клетки, включая и те, которые способствуют её малигнизации. Данное направление является малоизученным, однако уже на столь ранних этапах исследований полученная информация позволила учёным развить такие направления, как противоопухолевая терапия, генная инженерия и т.д. Это обстоятельство делает изучение Notch белков весьма перспективной направленностью в науке.
notch белки
стволовые клетки
сигнальный путь
эмбриогенез
канцерогенез
микроокружение.
1. М. А. Богданова, А. А. Костарева, А. Б. Малашичева. «Роль сигнального пути Notch в дифференцировке мезенхимных стволовых клеток жировой ткани человека», 2014. С. 2-3, 8-9-11¬.
2. М.В. Новикова, В.А. Рыбко, Н.В. Хромова, М.Д. Фармаковская, П.Б. Копнин. «Роль белков Notch в процессах канцерогенеза», 2015. С. 3-4, 6-12.
3. Alberi L., Lui S., Wang Y. et al. Activityinduced Notch aling in neurons requires Arc/Arg3.1 and is essential for synaptic plasticity in hippocampal networks. Neuron 2011;69(3):437-44.
4. Capaccione K. M., Pine S. R. The Notch aling pathway as a tor of tumor survival. Carcinogenesis 2013;34(7):1420-30, 32.
5. Louvi A., Artavanis-Tsakonas S. Notch and disease: a growing field. Semin Cell Dev Biol 2012;23(4):473-80.
6. Weng A. P., Ferrando A. A., Lee W. et al. Activating mutations of NOTCH1 in human T cell acute lymphoblastic leukemia. Science 2004;306(5694):269-71, 74.
7. Zanotti S., Canalis E. Notch aling in skeletal health and disease // Eur. J. Endocrinol. 2013. Vol. 168. P. 94-95-103.
8. Zhu F., Sweetwyne M., Hankenson K. PKCδ is required for Jagged-1 induction of human mesenchymalstem cell osteogenic differentiation // Stem Cells. 2013. Vol. 31. P. 1181-1192.
Специалисты в области микробиологии, цитологии и эмбриологии давно задавались рядом вопросов: каким образом происходит выбор клеткой своего жизненного пути? Почему возникают организмы, пораженные конгенитальными патологиями? Что способствует отклонению развития от нормы? Каким образом эти процессы могут быть связаны с канцерогенезом? Ответы на данные задачи учёные получили в ходе детального исследования микроокружения клеток, а также механизмов межклеточного взаимодействия, среди которых особую роль играют трансмембранные рецепторы семейства Notch.
Белки семейства Notch – интегральные белки-рецепторы, у человека представленные четырьмя типами (Notch 1-4). Данные белки осуществляют контроль пролиферации, дифференцировки и развития клеток и тканей, а также активируют транскрипцию генов, участвующих в регуляции баланса между этими процессами [1].
В 1913 г. в ходе исследования дифференцировки эктодермы, проводимых на экспериментальной форме Drosophila melanogaster, американским биологом Томасом Хантом Морганом были открыты белки-факторы роста, играющую особую роль в созревании и функционировании клетки. Позднее были получены сведения о нарушениях развития D. melanogaster в случае повреждения участков гена NOTCH (Дж. С. Декстер, 1914 г.) и участии сигнального пути Notch в онтогенезе (Д. Полсон, 30-е гг. XX века) [2].
Строение рецепторов сигнального пути Notch удалось изучить лишь после клонирования и секвенирования гена. Было установлено, что данные белки представляют собой огромные молекулы-димеры, имеющие молекулярную массу в пределах 300 кДа, содержащие специфические для данного семейства внутриклеточный и внеклеточный домены с множественными (от 26 до 29) EGF-подобными повторами, способными связывать лиганд [1, 2].
Активация сигнального пути Notch является уникальной. Она происходит при непосредственном физическом контакте данных белков с клетками, содержащими на своей поверхности лиганды к Notch-белкам. У млекопитающих описано 7 родственных друг другу лигандов (семейства Delta, Serrate и Lag-2 (DSL), Serrate-like ligands (Jagged1, Jagged2), Delta-like ligands (DLL1,-3,-4), каждый из которых является трансмембранной формой белков, обеспечивающих взаимодействие соседних клеток друг с другом. Связь между Notch-белками и данными лигандами была доказана в работе, проведенной на Caenorhabditis elegans, выявившей взаимосвязь интегрального белка γ-секретазы и сигнального каскада Notch. Это открытие позволило ученым предположить, что после контакта рецептора Notch со специфичным ему лигандом происходит отщепление внутриклеточного домена данного рецептора N-IC (Notch Intracellular Domain, NICD), транспорта домена в ядро, где начинается активация транскрипции генов семейств HES и HEY, ответственных за специализацию и жизненный цикл клетки [1].
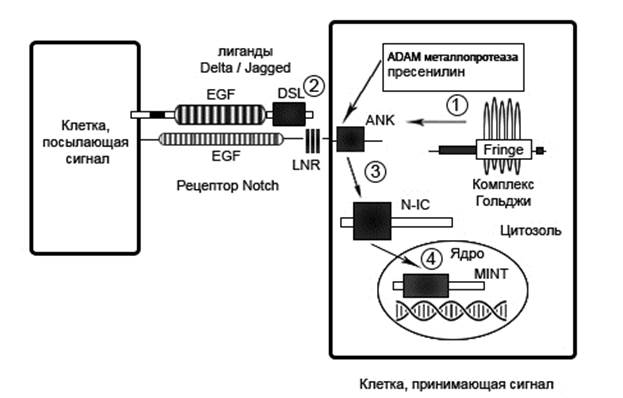
Рис. 1. Каноническая активация сигнального пути Notch. На схеме указаны основные участники и некоторые целевые гены. 1 – Рецептор Notch расщепляется фуриноподобной протеазой в комплексе Гольджи и переносится на клеточную поверхность в качестве гетеродимера. Возможно его гликозилирование белками Fringe аппарата Гольджи. 2 – После экспрессии на поверхности клетки Notch взаимодействует с лигандами (DSL, Jagged1 и др.). 3 – После связывания лиганда с рецептором лиганд расщепляется металлопротеазой ADAM и γ-секретазой для освобождения N-IC. 4 -N-IC инициирует свои последующие эффекты путем миграции на ядро и связывания с его элементами.
Активация данного пути является сверхточным процессом. Это доказали исследования, проводимые на экспериментальных животных. Согласно полученным данным, выбор правильного клеточного пути во многом зависит от баланса между количеством рецепторов и лигандов к ним. К примеру, недостаточность Jagged1 вызывает пороки развития многих систем органов у людей [1].
Учёные выделяют две категории белков-регуляторов сигнального пути: активаторы и ингибиторы. К первым можно отнести ядерные белки Deltex и MINT: в зависимости от контекста они определяют, стоит ли экспрессировать тот или иной ген. Среди супрессоров транскрипционных механизмов наиболее изучены LNX, SEL-10, Numb и Itch [2].
Присоединение остатков сахаров к молекулам Notch-белков, а также их лигандам при помощи Fringe действует в роли критического регулятора активации сигнального пути. Посредством модификации EGF-подобных повторов происходит усиление Delta сигналов и подавление Serrate. Таким образом на клеточном уровне организации удаётся разграничить друг от друга несколько видов тканей и сохранить их специфичность. На данный момент установлено лишь три белка, относящихся к Fringe-комплексу. Это LFng, MFng и RFng. Посредством экспериментов на мышах было выявлено, что LFng особенно необходим для дифференцировки сомитов в области будущей грудной клетки и позвоночника [2, 7].
Процесс активации сигнального пути Notch в разных тканях неодинаков. Различия объясняются типом ткани, клеточного окружения, сигнала, лиганда и степенью содержания белков семейства Notch в данной клетке [8].
На данном этапе исследований остаётся неизвестным, усиливают ли гены-компоненты сигнального пути Notch потенциал к тканеспецифичной дифференцировке или ингибируют его. Опубликованы противоречивые данные, связанные со спектром действия белков Notch на дифференцировку клеток. Например, при контакте NICD человеческих мультипотентных мезенхимных стволовых клеток (ММСК) с лигандом семейства Jagged1, транскрибированного при участии экзогенного белка Jag1, ведёт к усилению межклеточного взаимодействия, т.е. активации остеогенного клеточного дифферона ММСК. Введение же активированного домена NICD в ММСК мыши in vitro приводит к подавлению дифференцировки остеогенных клеток, а in vivo – к снижению плотности массы костной ткани [2].
Важны Notch и для уже дифференцированных клеток. Доказано, что связывание DSL лигандов с активированными Notch-рецепторами обеспечивает такие процессы, как клеточная память и синаптическая пластичность нейронов. Кроме того, передача сигналов Notch регулирует дифференцировку клеток-составляющих нейроглии и арборизацию (т.е. ветвление наподобие дерева) нейронов [3].
Влияние типа активированного рецептора на Notch-эффект демонстрируется следующим образом: стимуляция Notch1 ингибирует процесс созревания зрелых остеолкастов, в то время как активирование Notch2 приводит к усиленному остеокластогенезу [7].
Также при дифференцировке клеток имеет значение момент действия Notch-белка. Так, решающим регулятором судьбы развивающегося кардиомиоцита может стать своевременная активация доменов Notch1, -4, вырабатываемых эндотелиоцитами васкуляризирующих тканей. Через множественные взаимодействия будущего миокарда с нервным гребнем данные гены приводят к развитию внутренней сердечной оболочки и морфогенезу сердечных клапанов и камер. Notch также необходимы для дифференцировки коронарного сосуда. Однако, взаимодействие рецепторов Notch с лигандом HEY2 на более позднем этапе может повлечь недоразвитие сердечных клапанов и возникновение аритмии [5]. Учёные предполагают, что для запуска подобных каскадных реакций необходим своеобразный пороговый уровень сигнализации Notch пути. Превышение или недостаточная степень реагирования на лиганды приводят к инактивации сигналов определения жизненного пути клетки. Таким образом осуществляется регуляция стволовых свойств мультипотентных клеток или их дифференцировка на генетическом уровне [1].
Известно, что мутации доменов, входящих в сигнальный путь Notch, приводят к серьёзным заболеваниям опорно-двигательного аппарата (остеопения, остеосаркома, дизостоз, брахидактилия). Зачастую это происходит вследствие формирования искажённого набора соматических границ в эмбриогенезе. Причиной такого явления становится нарушение периодичности активации генов, участвующих в передаче Notch-сигналов (HES1, DLL1, -3) [7,8].
Выделяют ряд целевых генов Notch-белков, которые определяют направление сигнального пути Notch. Регуляторами клеточного цикла являются CyclinD1, NRARP, NF-κB, TP21, pre-Tα. Маркерами злокачественных новообразований служат C-MYC, IGF1-R, SURVIVIN, SLUG. Белки HES1 и HEY1 являются не только непосредственными мишенями для сигнального пути Notch, но также действуют как ингибитор транскрипционных процессов, тем самым регулируя клеточный цикл [2].
Семейство Notch осуществляет контроль над эмбриональным развитием не только в виде определения направления развития клетки, но также посредством пары механизмов. Первый получил название латеральная спецификация. Она происходит, когда клетки одного типа одновременно задействованы как в экспрессии белков и лигандов, так и в принятии их сигналов на одной стадии активации Notch пути. Обычно данный процесс характеризуется выраженной асимметрией, поскольку клетка самостоятельно выбирает, какое соединение и в каком объеме ей необходимо секретировать. При этом клетка, проходящая этапы дифференцировки (например, в нейробласт), ингибирует аналогичные процессы у соседних клеток. В будущем это отразится следующим образом: 1) произойдёт разделение специфических клеточных типов друг от друга; 2) будут сформированы границы между тканями. Второй способ – индуктивная передача сигналов – заключается в экспрессии белков и их лигандов клетками двух различных типов, т.о. удаётся осуществить активацию Notch только в тех клетках, плазмалемма которых несёт на своей поверхности Notch-рецепторы. [1, 2, 5].
Определённую роль белки Notch играют также и в коррекции процессов гемопоэза, который являет собой баланс между самообновлением и дифференцировкой кроветворных стволовых клеток. Гемопоэтические ткани и органы обычно богаты данным типом белков. Здесь сигнальный путь Notch активируется в ходе взаимодействия его рецепторов с лигандами Jagged1, DLL 1 и 4, которые несут на себе клетки стромы красного костного мозга. Экспрессируются они и в тимусе, что говорит о важности данного сигнального каскада для формирующихся Т-клеток. Активация генов Notch1 и Notch2 была обнаружена в гранулоцитах [6].
В ходе экспериментов учёными было показано, что гиперактивация семейства Notch-белков способствует возникновению различных форм неоплазий, вызванных нарушениями в структуре генов, ответственных за апоптоз клетки [5].
Перспективным направлением является изучение сигнального пути Notch как маркера клеточных патологий, в частности, канцерогенеза, поскольку Notch-белки контролируют ключевые процессы жизнедеятельности клетки. Характерной особенностью Notch является влияние на пролиферацию опухолевых клеток или её подавление в зависимости от микроокружения в пределах одной и той же опухоли [4].
В 1991 г. L.W. Ellisen вместе с соавторами доказали вовлеченность сигнального пути Notch в стимуляцию опухолевых процессов во время изучения на экспериментальном животном Т-клеточного острого лимфобластного лейкоза (Т-ОЛЛ). В ряде случаев нарушение структуры доменов Notch приводило к образованию химерного белка Notch 1/ TCRβ, имитирующего NICD. Позднее была обнаружена мутация гена Notch1, в 56% случаев приводящая к Т-ОЛЛ. В 31% мутации Notch1 обнаруживалась хроническая лимфоцитарная лейкемия (ХЛЛ). Предполагается, что для решения подобной проблемы может быть использована лиганд-независимая активация Notch-рецепторов. Она приведёт к стабилизации N-IC внутри гена, однако неблагоприятный прогноз по-прежнему будет сохраняться [4].
В крупных опухолях сигнальный путь Notch был впервые обнаружен в вирусе мышиной опухоли молочной железы, причиной которого считается мутация гена Notch4, а также повышенный синтез Notch1 и взаимодействие его с лигандом Jagged1 [6].
В целом, считается, что сигнальный путь Notch оказывает в основном проонкогенное действие, вызывая такие патологии, как Т-ОЛЛ, ХЛЛ, аденокарцинома легкого, рак молочной и поджелудочной железы, меланома [2]. В качестве опухолевого супрессора белки Notch действуют при связывании с лигандами на поверхности клеток, вызывающими плоскоклеточный рак кожи и рак шейки матки [4]. Потеря пресенилина – каталитической субъединицы γ-секретазы – способствует потере активности данного белка и развитию болезни Альцгеймера. Notch-белки также способствуют выживанию опухолевых клеток и их устойчивостью к химиотерапии [2].
Подводя итоги, можно сказать, что белки семейства Notch и инициируемый ими сигнальный путь являются уникальными среди всех белков человеческого организма. В зависимости от клеточного контекста белки Notch регулируют разнообразные интрацеллюлярные процессы, а в ряде случаев становятся причиной серьёзных мутаций. Дальнейшие исследования сигнального пути Notch могут быть использованы для разработки методики противоопухолевой терапии, создания и поддержания специфичных свойств стволовых клеток, искусственной регуляции таких процессов, как ангиогенез, гемопоэз и др., что делает это направление весьма перспективным.
Библиографическая ссылка
Кутузова Л.А., Меметова А.А., Силиверст О.Н. РОЛЬ БЕЛКОВ СЕМЕЙСТВА NOTCH В ЖИЗНЕДЕЯТЕЛЬНОСТИ КЛЕТКИ // Международный студенческий научный вестник. – 2018. – № 6.;
URL: https://eduherald.ru/ru/article/view?id=19271 (дата обращения: 01.06.2021).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
Сколько срастается перелом, зависит от степени тяжести полученной травмы, возраста пациента и соблюдения всех врачебных предписаний во время восстановительного периода.
У людей пожилого возраста срок срастания костной ткани значительно больше по причине недостаточного количества кальция в организме и возрастных изменений, которые затягивают процесс восстановления всего организма.
Стадии регенерации костей
В медицинской практике были выделены следующие регенерационные стадии:
Катаболизм структур ткани и клеточной инфильтрации. Ткань после повреждения отмирает, происходит распад клеток на элементы, появляются гематомы.
Стадия дифференцировки клеток. Для этого этапа характерно первичное срастание костей. При хорошем кровоснабжении сращение проходит по типу первичного остеогенеза. Длительность процесса занимает 10-15 суток.
Стадия образования первичного остеона. Костная мозоль начинает формироваться на поврежденной области. Осуществляется первичное срастание. Пробивается ткань капиллярами, белковая ее основа затвердевает. Хаотичная сеть трабекул кости прорастает, а они, соединяясь, формирую остеон первичный.
Стадия спонгиозации мозоли. Для этого этапа характерно появление пластичного костного покрова, появляется корковое вещество, восстанавливается поврежденная структура. В зависимости от тяжести повреждения эта стадия может длиться как несколько месяцев, так и до 3 лет.
Обязательное условие для нормально срастающегося перелома является протекание стадий восстановления без нарушений и осложнений.
Скорость заживления переломов у взрослых
Процесс срастания костей сложен и занимает продолжительное время. При закрытом переломе в одном месте конечности скорость заживления высока и составляет от 9 до 14 дней. Множественное повреждение заживает в среднем около 1 месяца. Самым опасным и долгим для восстановления считается открытый перелом, период заживления в таких случаях превышает 2 месяца. При смещении костей относительно друг друга еще больше увеличивается длительность процесса регенерации.
Заживление переломов верхних конечностей происходит медленно, но они представляют меньшую опасность для человека, чем повреждения нижних конечностей. Заживают они в следующие сроки:
фаланги пальцев – 22 дня;
кости запястья – 29 дней;
лучевая кость – 29-36 дней;
локтевая кость – 61-76 дней;
кости предплечья – 70-85 дней;
плечевая кость – 42-59 дней.
Сроки заживления переломов нижних конечностей:
пяточная кость – 35-42 дня;
плюсневая кость – 21-42 дня;
лодыжка – 45-60 дней;
надколенник – 30 дней;
бедренная кость – 60-120 дней;
кости таза – 30 дней.
Причинами низкой скорости заживления могут стать неправильное лечение, избыточная нагрузка на сломанную конечность или недостаточный уровень кальция в организме.
Скорость заживления детских переломов
У ребенка лечение перелома происходит быстрее на 30%, по сравнению со взрослыми людьми. Это обусловлено высоким содержанием оссеина и белка в детском скелете. Надкостница при этом толще, у нее отличное кровоснабжение. Скелет детей постоянно увеличивается, и присутствие зон роста ускоряет еще больше костное срастание. У детей с шестилетнего до двенадцатилетнего возраста при поврежденной ткани кости наблюдается коррекция отломков без оперативного вмешательства, в связи с чем в большинстве ситуаций специалисты обходятся только наложением гипса.
Самые частые переломы у детей:
Полные. Кость в таких случаях разъединяется на несколько частей.
Компрессионные переломы происходят по причине сильного сдавливания вдоль оси трубчатой кости. Заживление происходит за 15-25 дней.
Перелом по типу «зеленой ветви». Происходит изгиб конечности, при этом образуются трещины и отломки. Возникает при чрезмерном давлении с силой, недостаточной для полного разрушения.
Пластический изгиб. Появляется в коленных и локтевых суставах. Наблюдается частичное разрушение костной ткани без рубцов и трещин.
Первая помощь при переломе
Большую роль на скорость сращивания сломанных костей влияет оказание первой помощи при переломах. Если это открытый перелом, очень важно чтобы в рану не попала инфекция, чтобы избежать воспаления и нагноений на этом участке. Поэтому поврежденный участок нужно обеззаразить, для этого окружности ранения стоит обработать антисептиком, и накрыть стерильной салфеткой до приезда команды медиков.
Чтобы транспортировать в медицинское заведение пострадавшего, необходимо организовать иммобилизацию конечности. Используют для выполнения задачи подручные средства – фанеру, плоские доски, ветви деревьев, которые тканью либо бинтом закрепляют к поврежденной конечности. Если у человека наблюдается травма позвоночника, то для транспортировки используются твердые носилки, либо подручные средства, например плоские доски, на которые нужно аккуратно уложить больного.
Сроки консолидации переломов напрямую зависят от оказания первой помощи и скорой транспортировке потерпевшего в больницу.
Механизм заживления
Сращивание переломов начинается сразу после получения травмы. Срастание может быть двух видов:
- Первичное сращивание. Если кости надежно соединены, наращивание костной мозоли на сломанном участке не нужно, перелом сращивается легко и с хорошим кровообращением.
- Вторичное сращивание. В этом случае необходимо нарастить костную мозоль, из-за активного движения костных отломков.
Механизм сращивания переломов очень сложный, поэтому делится на определенные стадии:
- Первая стадия заключается в образовании сгустка, образующегося из крови, окружающей поврежденный участок. Спустя некоторое время они трансформируются в новую ткань для строения кости. Такой сгусток образуется в течение нескольких дней после получения травмы.
- На второй стадии этот сгусток наполняется клетками остеобластами и остеокластами. Они очень сильно сопутствуют заживлению и восстановлению. Заполняя сгусток вокруг перелома, они сглаживают и выравниваются костные обломки, после чего создается гранулярный мост. Именно он будет удерживать края кости, для предотвращения смещения.
- Третья стадия характеризуется появлением костной мозоли. Через несколько недель (2-3) от получения травмы, гранулярный мост превращается в костную ткань. В этот промежуток времени она еще очень хрупкая, и отличается от обыкновенной костной ткани. Этот участок и называется костной мозолью. Чтобы он не повредился, важно чтобы перелом был надежно иммобилизован.
- В период четвертой стадии происходит полное сращивание перелома. Спустя определенное время после происшествия, в зависимости от его тяжести и участка (3-10 недель), на этом месте полностью нормализуется кровообращение, что способствует укреплению кости. Ткань восстанавливается немного дольше (6-12 месяцев).
По окончании всех стадий, сросшаяся кость снова обретает свою прочность, и способна выдерживать разные нагрузки.
Факторы, влияющие на скорость сращения костей
Заживление сломанной кости зависит от ряда факторов, которые либо ускоряют его, либо препятствуют ему. Сам процесс регенерации индивидуален для каждого пациента.
Оказание первой помощи имеет решающее значение для скорости заживления. При открытом переломе важно не допустить попадания в рану инфекции, т.к. воспаление и нагноение замедлят процесс регенерации.
Заживление происходит быстрее при переломе мелких костей.
При открытых переломах костная мозоль образуется гораздо дольше, если развивается раневая инфекция, которая сопровождается костной секвестрацией и остеомиелитом посттравматическим. Именно поэтому при неправильной терапии перелома формирование костной мозоли замедляется или вообще не наступает. В таких ситуациях появляются долго не срастающиеся переломы, отличающиеся медленной консолидацией, а также ложные суставы:
Если пациенты страдают гиповитаминозом и авитаминозом (остеомаляция у беременных, рахит, цинга).
Если есть нарушения деятельности паращитовидных желез (уменьшение концентрации кальция в крови) и надпочечниковые гиперфункции.
Наличие сопутствующих заболеваний, протекающих в хронической стадии, а также воспалительных процессов. Любые патологические процессы в организме значительно затягивают срок восстановления после перелома.
Наличие избыточной массы тела негативно влияет на процесс заживления костной ткани.
Нарушение метаболизма.
Несоблюдение сроков ношения гипсовой повязки. Многие случаи слишком долгого срастания костной ткани связаны с тем, что человек не хочет долго ходить в гипсе, снимает его раньше срока, установленного врачом. Срастающийся участок кости находится под давлением, происходит смещение.
Как быстро срастаются кости, зависит и от такого фактора, как необходимость установки импланта. Встречается это в тех случаях, когда осколков кости слишком много, они очень мелкие, и собрать их заново не представляется возможным.
Как ускорить срастание костей?
Чтобы процесс восстановления кости происходил быстрее, следует получить адекватное лечение, обеспечить пациенту правильное питание, прием витаминных комплексов, обогащенных кальцием, витамином D. Источником последнего компонента являются куриный желток и солнечные лучи.
Процесс срастания костей после перелома, не в последнюю очередь зависит от количества кальция в организме («строительного» минерального элемента для костной ткани). Для повышения концентрации данного элемента в организме пациенту назначаются специальные медицинские препараты. В обязательном порядке корректируется питание, основу рациона должны составлять молочные продукты.
Пациентам с повреждением костей рекомендована физическая активность уже через несколько суток после травмы. Физические упражнения можно разделить на занятия в период иммобилизации и активность в период постиммобилизации.
В то время, когда наложен гипс, нагрузка дается для профилактики застойных процессов. Выполняются следующие упражнения:
идеомоторные упражнения – мысленное сохранение двигательной активности в поврежденной зоне;
упражнения для свободных мышц для сохранения активности и профилактики мышечной атрофии;
статические упражнения для поддержания тонуса;
упражнения для противоположной конечности.
Тщательное выполнение всех этих пунктов обязательно ускорит процесс восстановления, а кость срастется быстро и правильно.
Источник
