Метаэпифизарный перелом у детей
Острый гематогенный метаэпифизарный остеомиелит (МЭО) у детей ранней возрастной группы продолжает оставаться тяжелым гнойно-септическим заболеванием в педиатрической хирургической практике [1,2]. В последнее десятилетие он занимает одно из первых мест в гнойно-септической хирургии по частоте исхода в бактериальный сепсис. Динамика количества случаев заболевания не имеет четкой тенденции к снижению, что подтверждается высокой частотой встречаемости патологического процесса среди новорожденных, в т.ч. маловесных недоношенных детей, имеющих ряд физиологических и иммунологических особенностей, усугубляющих тяжесть течения заболевания [3]. Значимым в этиологии является патоморфоз возбудителей последнего десятилетия, характеризующийся уменьшением частоты роста культур моностафилококковой флоры (Stafilococcusaureus) до 50 %. Отмечается активный рост микст-культур эпидермального стафилококка с другими микроорганизмами (клебсиеллами, энтерококками), их ассоциации с анаэробами и культурами грибов рода Кандида [4]. Многообразие клинических проявлений процесса и наличие атипичных форм могут увести от своевременной постановки диагноза МЭО. Этиопатогенез заболевания отличается тем, что до оссификации эпифизов имеет место морфофункциональная незрелость ростковой зоны, хондробласты расположены хаотически, их упорядочивание происходит параллельно оссификации эпифиза (от центра зоны роста в направлении к периферии), и в соответствии с этим зона роста постепенно приобретает барьерные свойства. Вот почему при отсутствии ядра окостенения, воспалительный процесс пенентрирует зону роста в центральной части, при появлении ядра оссификации пенентрация происходит в периферической части.
Поражение эпифиза сопровождается деструкцией последнего, с вовлечением в патологический процесс сустава и возникновением артрита, который в свою очередь приводит к патологическому вывиху и параартикулярной флегмоне. Дискредитированная ростковая зона частично или полностью погибает, и это в дальнейшем обусловливает возникновение приобретенных пороков развития (укорочение или удлинение, деформации конечностей).
Таким образом, исходом заболевания могут быть ортопедические осложнения, влекущие инвалидизацию ребенка, от 10 до 40 % случаев. МЭО представляет собой один из наиболее сложных вариантов течения гнойно-воспалительного процесса, требующего детального анализа течения заболевания, а также применения доступных для использования эффективных методов диагностики [5].
Цель исследования: изучить особенности клинического течения метаэпифизарного остеомиелита, провести сравнительный анализ возможностей различных методов диагностики.
В исследование включено 64 ребенка в возрасте от 0 до 3-х лет с острым гематогенным метаэпифизарным остеомиелитом, находившихся на стационарном лечении по поводу данного заболевания в отделении гнойной и экстренной хирургии ДОКБ г. Твери с 2005 по 2015 г. Для уточнения особенностей клинического течения различных форм МЭО был проведен анализ результатов стандартного комплекса клинико-диагностических мероприятий, проведенного у всех поступивших. Диагноз ставился на основании анализа жалоб больного, данных анамнеза, клинического осмотра, использовались методы бактериологической и лабораторной диагностики, методы медицинской визуализации (рентгенография, ультразвуковое исследование, компьютерная томография, магнитно-резонансная томография).
Результаты исследования и их обсуждение
В структуре обследуемых больных наибольшую группу составили дети до 1 года (n=4875 %), наиболее часто заболевание возникало в возрасте до 1 месяца (n=30; 46.8 %), от 1 г. до 3-х лет госпитализировано 16 (25 %) детей (таблица 1).
По половой принадлежности преобладали мальчики (n=39; 60.9 %). Больные из районов области составили 60.9 % (n=39). В первые трое суток болезни был госпитализирован 21 ребенок (32.8 %). Наибольшее число пациентов (n=33; 51.5 %) обратилось за помощью детского хирурга на 4–7 сутки заболевания. Оставшиеся в более поздние сроки (n=10; 15.5 %). Анализ сроков поступления в специализированный хирургический стационар выявил достаточно позднее обращение за медицинской помощью, что связано с трудностями ранней диагностики МЭО из-за многообразия клинических проявлений заболевания, отсутствия ранних патогномоничных жалоб, преобладания у малышей общих реакций над местными, особенностями психофизиологического статуса пациентов раннего возраста. Немаловажная роль принадлежит ошибкам диагностики на догоспитальном этапе. Учитывая распределение больных по месту обращения, замечено, что достаточно большая группа детей поступала из род. домов (n=17; 26.5 %), из стационара (отделение патологии новорожденных) – (n=21;32.8 %). По направлению участковых педиатров, хирургов травматологов (n=23;35.9 %), 3 человека обратились самостоятельно.
Для характеристики клинического течения МЭО использовалась классификация Т.П. Краснобаева. Встречалась местная форма (n= 53;82.8 %) заболевания, септикопиемическая (n= 11; 17.2 %), токсическая форма не зарегистрирована. Из септических осложнений на первом месте оказалась пневмония (n= 6;54.5 %). Также имели место перикардит (n=3;27.2 %), поражение почек (n=1; 9 %), средний гнойный отит (n=1;9 %). Локальная форма заболевания превалировала в возрастной группе от 1 г. до 3-х лет. Результаты оценки степени тяжести состояния показали, что дети поступали в стационар преимущественно в состоянии средней степени тяжести (n=36;56.2 %). В тяжелом состоянии доставлено 28 детей (43.7 %). Это связано с поздним обращением за специализированной хирургической помощью, низкой иммунологической резистентностью детского организма, быстрым нарастанием симптомов интоксикации ввиду выраженности альтеративного компонента воспалительной реакции в раннем возрасте. Дети, поступившие в тяжелом состоянии, были госпитализированы в отделение реанимации, где проводилось непрерывное мониторирование жизненно важных функций организма и интенсивная комплексная терапия заболевания. В типичных случаях заболевание начиналось остро: (n=52; 81.2%), возникала резкая боль в пораженной конечности (n= 49; 76.5 %). Появлялись и нарастали симптомы интоксикации: повышение температуры тела (n=60; 93.7 %), вялость, отказ от еды (n= 44; 68.7 %). В тяжелых случаях возникала тахикардия (n=9; 14 %), тахипноэ (n=8; 12.5 %) менингеальные явления (n=4; 6.25 %).
При клиническом осмотре обращало на себя внимание вынужденное положение конечности, ограничение или отсутствие активных движений, болезненность при пальпации и попытке пассивных движений. (n=56; 87.5 %), отмечалась выраженная стойкая контрактура суставов (n=48; 75 %), что связано с вовлечением в процесс связочного аппарата и параартикулярных тканей. В более поздние сроки появлялось увеличение объема сустава из-за наличия в его полости жидкости (2–5 сутки и позже), гиперемия над очагом поражения –(n= 43; 67 %).
Факторы риска развития заболевания выявлены в 34 (53.1 %) случаях. Это –неблагоприятный антенатальный период: внутриутробная гипоксия плода разной степени выраженности, очаги хронической инфекции, синдром интоксикации у матери, оперативные роды, травматизация в родах, недоношенность, перинатальное поражение ЦНС, катетеризация центральной вены, низкая оценка по шкале Апгар, предшествующие гнойные заболевания. Важная роль отводится гипоксии не только как промоутеру каскада метаболических нарушений, но и фактору, способствующему развитию генерализованных форм МЭО. Результаты проведенных исследований показали, что у всех больных с септикопиемической формой выявлены факторы риска [6,7].
По локализации остеомиелитического очага преобладало поражение эпифизов длинных трубчатых костей скелета с поражением суставов в виде гнойных артритов: бедренной кости с поражением тазобедренного сустава (n=26;40.6 %), большеберцовой (n=13; 20 %), малоберцовой (n=11; 17.1 %), костей предплечья (n=5;7.8 %). Множественное поражение костей при МЭО отмечено у 2 (3 %) детей.
Рис.1. Локализация очага воспаления
С целью выявления этиологического фактора заболевания применялись бактериоскопический и бактериологический методы исследования с определением чувствительности микрофлоры к антибиотикам. При первичном заборе биоматериала идентифицирован возбудитель у 46(71.8 %) больных. Анализ полученных результатов показал, что в большинстве случаев основным этиологическим фактором является золотистый стафилококк (n=28;43.7 %), также были обнаружены другие виды стафилококка (n=4;8.6 %), энтерококк и клебсиелла (n=2;3.1 %) в равных количествах, гемолитический стрептококк (n=3;4,6 %), протей (n=1;1.5 %), кишечная и синегнойная палочка (n=2;3.1 %) и (n=1;1.5 %) соответственно, полифлора (n=3;4.6 %).
Рис. 2. Результаты высева микрофлоры из очага поражения
При анализе изменений состава периферической крови, констатирована анемия (n= 34;53.1 %), лейкоцитоз (n= 57;89 %), палочкоядерный сдвиг (n= 49; 76.5 %), ускорение СОЭ (n=28; 43.7 %). У больных с септикопиемической формой регистрировалась тромбоцитопения (n=11;7.2 %) у большинства пациентов имелись признаки системного воспалительного ответа (нейтрофильный лейкоцитоз со сдвигом формулы влево). В биохимическом анализе крови сохранялась нормогликемия (n=58; 90.6 %). Гипергликемия зарегистрирована с максимальным значением 13 ммоль/л (n=4; 6.25 %). Гипогликемия с минимальным значением 2.8 ммоль/л (n=2; 3.1%). Изменения белкового спектра крови проявлялись умеренной гипопротеинемией (n=29; 45.3 %). Повышение уровня С-реактивного белка как неспецифического маркера воспаления определялось качественным методом, было положительным (n= 44; 68.7 %) и резко положительным (n=13;20.3 %). Также имел место отрицательный результат (n= 7; 10.9 %). Лабораторные показатели, характеризующие функцию почек, оставались в пределах референтных значений. Средние значения электролитного обмена соответствовали возрастной норме. В ряде случаев отмечено изменение фибринолитической активности (n= 24;37.5 %).
В последнее десятилетие МЭО занимает одно из первых мест в гнойно-септической хирургии по частоте исхода в бактериальный сепсис. Для ранней диагностики септического процесса, в случае ухудшения состояния ребенка проводился прокальцитониновый тест сыворотки крови экспресс-методом по Brachms (n= 14; 21 %). Выполнение исследования позволило определить клиническую форму заболевания. В результате была диагносцирована местная форма (n=5;7.8 %) – прокальцитонин сыворотки крови 2 состояние трактовалось как сепсис, осложнивший остеомиелит – (n= 9;14 %).
На диагностическом этапе установления МЭО применяли различные методы медицинской визуализации. В качестве стандартизированного лучевого метода исследования опорно-двигательного аппарата стартовым являлась рентгенография пораженного отдела скелета. (n=64; 100 %). Метод позволял оценить форму, контуры, соотношения между костями. Ранние рентгенологические признаки заболевания в виде утолщения мягких тканей на уровне поражения, расширения суставной щели, размытости контуров эпифиза, остеопороза края метафиза выявлены в среднем на 3–5 день болезни (n=19;29.6 %). На 10–14 день болезни регистрировалась периостальная реакция и очаги деструкции в метаэпифизарной зоне (n= 47; 73.4 %). Рентгенографический метод не обладает достаточной чувствительностью к визуализации хрящевых структур в начальные периоды развития заболевания.
Магнитно-резонансная томография (МРТ) является высокоинформативным методом, обладающим высокой чувствительностью и достаточной специфичностью в интрамедуллярную фазу МЭО, позволяет выявить изменения костного мозга, определить так называемые участки патологической гидратации, а также оценить суставные поверхности и околосуставные мягкие ткани. К недостаткам метода следует отнести необходимость проведения анестезиологического пособия для исключения двигательной активности пациентов младшей возрастной группы во время исследования. МРТ использовали в качестве уточняющей методики в интрамедуллярную фазу (n=4 ;6.25 %) [8].
Компьютерная томография (КТ) – метод выбора для оценки суставных поверхностей, мягких тканей, изменений костного мозга, позволяет выявить отек мягких тканей и деструкцию кости, не замеченную на обычных рентгенограммах, наилучший метод выявления секвестров. КТ недавно внедрена в работу клиники (n=8;12.5 %). Сопряжена с лучевой нагрузкой, зарекомендовала себя как оптимальный способ ранней диагностики МЭО, уже на 2-е сутки заболевания в кортикальном слое проявляются отчетливые рентгенодеструктивные изменения костных структур.
Ультразвуковая диагностика выполнена всем пациентам с МЭО (n=64;100 %), в дебюте заболевания (n=29;45.3 %). Методика показала высокую информативность (80 %), верифицируемую во время операции. Проникающая способность ультразвука у детей раннего возраста большая, чем у более старших, что связано с незавершенным процессом остеогенеза, когда эпифизы костей состоят в основном из хрящевой ткани. Исследование позволило оценить состояние мягких тканей, определить анатомические взаимоотношения в суставе, состояние капсулы (уплотнение и утолщение), суставной полости, ядер окостенения, определить утолщение надкостницы, распознать поднадкостничные абсцессы, визуализировать участки деструкции кости в метаэпифизарной зоне [9,10]. В процессе проведения исследования были обнаружены следующие УЗ-признаки изменения анатомических структур: утолщение мягких тканей, повышение эхогенности, жидкостные парартикулярные скопления (n=32;50 %); изменения внутрисуставной полости (утолщение капсулы сустава, наличие внутрисуставной жидкости – n=39;60.9 %); изменения однородности эпифизарного хряща (n=34;53 %); изменение формы и структуры ядра окостенения эпифизарного конца конечности (n=27;42.1 %); изменения метаэпифизарной зоны (нечеткость, неровность дефект зоны предварительного обызвествления, анэхогенные участки и включения – n=43 67.1 %); изменения надкостницы (неровность наружного контура, утолщение, повышение эхогенности n=25;39 %). Основной УЗ-признак МЭО –изменения в метаэпифизарной зоне – появлялся на 4–7 день болезни.
Т.о., резюмируя полученные результаты, отмечено, что метаэпифизарный остеомиелит наиболее часто встречается в группе новорожденных детей, у каждого из которых обнаружены факторы риска возникновения заболевания в виде внутриутробной гипоксии плода, наличия очагов хронической инфекции и синдрома интоксикации у матери, недоношенности. В большинстве случаев в дебюте заболевания преобладало наличие общей симптоматики. Локальные проявления прогрессировали медленно. Основным этиологическим фактором являлся золотистый стафилококк. Первичный очаг воспаления локализовался преимущественно в эпифизах длинных трубчатых костей нижних конечностей. В ранней диагностике заболевания методом выбора является компьютерная томография и ультразвуковое исследование.
Источник статьи: https://science-education.ru/ru/article/view?id=26630
Источник
Переломы дистального отдела лучевой кости у детей: эпифизеолиз и перелом Смита. Диагностика и лечение
При подозрении перелома дистального отдела лучевой кости у детей очень важно исключить диагноз эпифизеолиза. Авторы рекомендуют срочно направлять всех детей к ортопеду для репозиции под общей анестезией.
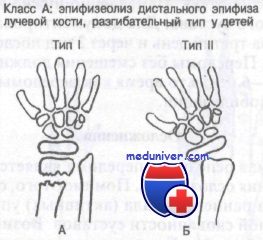
Класс А: эпифизеолиз дистального конца лучевой кости у детей, разгибательный тип. Обычно возникает при падении на вытянутую руку с насильственной дорсофлексией кисти и эпифизарной пластинки. Результатом этого является перелом Salter I или II типа. Нарушение роста кости нетипично, но возможно, поэтому эти больные требуют неотложного направления к ортопеду.
При лечении этих переломов допустима большая степень поперечного и углового смещения. Репозицию проводят при угловой деформации более 25° или смещении свыше 25% диаметра лучевой кости. Иммобилизацию делают одним из двух способов. При стабильных переломах врач должен наложить короткую переднезаднюю лонгету с предплечьем в положении супинации и лучезапястным суставом в положении легкого разгибания.
При нестабильных переломах авторы рекомендуют иммобилизацию большими переднезадними лонгетами с предплечьем в положении супинации и лучезапястным суставом в положении сгибания. Некоторые авторы защищают методику, по которой иммобилизацию осуществляют при разогнутом положении кисти. Другие считают, что следует избегать разгибания лучезапястного сустава, поскольку при этом возникают силы дистракции, действующие в ладонном направлении. Если перелом после закрытой репозиции остается нестабильным, показана фиксация спицей или открытая репозиция.

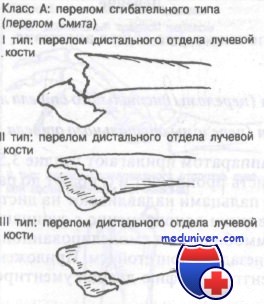
Класс А: сгибательный тип перелома лучевой кости у детей – перелом Смита
Этот перелом часто описывают как обратный перелом Коллиса. Перелом нетипичен и редко захватывает дистальный лучелоктевой сустав. Используемая здесь классификация, разработанная Thomas, включает как терапевтические, так и прогностические аспекты.
К переломам дистального отдела предплечья сгибательного типа приводят два механизма воздействия. Сгибательный перелом может произойти от падения на супинированное предплечье с кистью в положении тыльного сгибания. Кроме того, удар сжатым кулаком при слегка согнутом лучезапястном суставе может стать причиной сгибательного перелома. Прямой удар по дорсальной поверхности запястья или лучевой кости при согнутой кисти и пронированном предплечье также может привести к сгибательному перелому.
На ладонной поверхности запястья отмечают боль и припухлость. Необходимо обследовать и документировать сохранность и функцию лучевой артерии и срединного нерва.
Для выявления этого перелома достаточно обычных снимков в переднезадней и боковой проекциях.
Иногда этим переломам сопутствуют переломы или вывихи костей запястья.
Лечение переломов дистального конца лучевой кости у детей
Для детей предпочтительнее общая анестезия, для взрослых — регионарная блокада.
Класс А: I mun (переломы дистального отдела лучевой кости), II тип (переломы дистального отдела лучевой кости). Тракционным аппаратом прилагают усилие 3,5—4,5 кг при согнутом локте. Затем кисть пронируют и сгибают до расклинивания фрагментов. Большими пальцами надавливают на дистальный фрагмент в дорсальном направлении одновременно с супинацией до его вправления. Предплечье иммобилизуют смоделированной большой гипсовой повязкой или переднезадней лонгетой. Сразу после репозиции делают рентгенографию для документирования адекватности репозиции.
Класс А: III тип (переломы дисталъного отдела лучевой кости). Этих больных необходимо срочно направить к ортопеду для внутренней фиксации костных отломков.
При всех этих типах переломов осложнения встречаются не часто и включают повреждение сухожилия и развитие остеоартроза.
– Также рекомендуем “Краевые переломы лучевой кости – переломы Бартона, Гетчинсона. Диагностика и лечение”
Оглавление темы “Переломы костей предплечья, плеча”:
- Перелом диафиза лучевой кости. Диагностика и лечение
- Переломы диафиза локтевой кости. Диагностика и лечение
- Перелом локтевой кости III типа – переломы Монтеджи. Диагностика и лечение
- Сочетанные переломы лучевой и локтевой костей. Диагностика и лечение
- Разгибательные переломы костей предплечья Коллиса. Диагностика и лечение
- Переломы дистального отдела лучевой кости у детей: эпифизеолиз и перелом Смита. Диагностика и лечение
- Краевые переломы лучевой кости I типа – переломы Бартона. Диагностика и лечение
- Переломы дистального отдела плечевой кости. Классификация, диагностика и лечение
- Надмыщелковые разгибательные переломы плечевой кости. Диагностика и лечение
- Надмыщелковые сгибательные переломы плечевой кости. Диагностика и лечение
Источник
